题目内容
早在1807年化学家戴维用电解熔融氢氧化钠制得钠: 4NaOH(熔)  4Na
+ O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:
4Na
+ O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:

3Fe+4NaOH Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e →H2↑+O2↑
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数相同
D.目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阳极,铁为阴极
【答案】
D
【解析】
试题分析:A、由4NaOH(熔) 4Na+O2↑+2H2O可知,阳极氢氧根离子放电生成氧气和水,电极反应为4OH--4e-=2H2O+O2↑,故A错误;B、1100℃时生成Na蒸气,有利于反应正向移动,但Na的还原性大于Fe,故B错误;C、由4NaOH(熔)
4Na+O2↑+2H2O可知,阳极氢氧根离子放电生成氧气和水,电极反应为4OH--4e-=2H2O+O2↑,故A错误;B、1100℃时生成Na蒸气,有利于反应正向移动,但Na的还原性大于Fe,故B错误;C、由4NaOH(熔) 4Na+O2↑+2H2O、3Fe+4NaOH
4Na+O2↑+2H2O、3Fe+4NaOH Fe3O4+2H2↑十4Na↑可知,戴维法生成4molNa转移4mol电子,但盖•吕萨克法生成4molNa转移8mol电子,故转移电子不等,因此C错误;D、石墨极为阳极,氯离子放电,在阴极钠离子放电,发生反应2NaCl
Fe3O4+2H2↑十4Na↑可知,戴维法生成4molNa转移4mol电子,但盖•吕萨克法生成4molNa转移8mol电子,故转移电子不等,因此C错误;D、石墨极为阳极,氯离子放电,在阴极钠离子放电,发生反应2NaCl 2Na+Cl2↑,故D正确,答案选D。
2Na+Cl2↑,故D正确,答案选D。
考点:考查金属冶炼以及电解原理的有关判断

练习册系列答案
相关题目
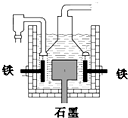 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为4NaOH(熔融)═4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法不正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为4NaOH(熔融)═4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法不正确的是( )| A、电解熔融氢氧化钠制钠,阴极发生电极反应为:Na++e-═Na | B、盖?吕萨克法制钠原理是熵的增加带动了反应的进行 | C、若戴维法与盖?吕萨克法制得等量的钠,则两反应中转移的电子总数比为1:1 | D、目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
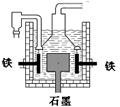 早在1807年化学家戴维用电解熔融氢氧化钠制得钠, 4NaOH(熔)
早在1807年化学家戴维用电解熔融氢氧化钠制得钠, 4NaOH(熔)