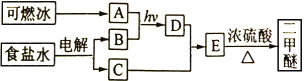
题目内容
【题目】粉末状试样A是由![]() 和Fe2O3组成的混合物。进行如下实验:
和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取![]() 全部溶于
全部溶于![]() 盐酸中,固体全部溶解,得溶液C;
盐酸中,固体全部溶解,得溶液C;
③将①中得到的单质B和溶液C反应,放出![]() (标况)气体。同时生成溶液D,还残留有固体物质B;
(标况)气体。同时生成溶液D,还残留有固体物质B;
④用![]() 溶液检查时,溶液D不变色。
溶液检查时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是____________,产物中的单质B是___________________。
(2)②中所发生反应的化学方程式是____________、____________。
(3)③中所发生反应的离子方程式是____________、____________。
(4)若溶液D的体积仍视为![]() ,则该溶液中
,则该溶液中![]() 为____________,
为____________,![]() 为____________。
为____________。
【答案】加入氯酸钾插上镁条点燃镁条引起 Fe MgO+2HCl=MgCl2+H2O Fe2O3+6HCl=2FeCl3+3H2O Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+ 0.67mol/L 2.33mol/L
【解析】
①铝热反应的本质是置换反应,金属性Al>Fe,所以发生Al与Fe2O3反应,置换出铁,即B为Fe;
②MgO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水,溶液C中含有MgCl2、FeCl3;
③单质B和溶液C反应,放出1.12L(标准状况)气体,该气体为氢气,说明②中盐酸过量,溶液C为MgCl2、FeCl3、HCl混合溶液,反应同时生成溶液D,还残留有固体物质B,说明Fe有剩余,结合④用KSCN溶液检验时,溶液D不变色,说明D溶液不含铁离子,则D中溶质为MgCl2、FeCl2,据此分析解答。
(1)①中引发铝热反应的操作为:加少量KClO3,插上镁条并将其点燃;产物中的单质B是Fe,故答案为:加少量KClO3,插上镁条并将其点燃;Fe;
(2)氧化镁与盐酸反应生成氯化镁与水,氧化铁与盐酸反应生成氯化铁与水,②中所发生反应的化学方程式为:MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O,故答案为:MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O;
(3)Fe与盐酸反应生成氯化亚铁与氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,铁与氯化铁反应生成氯化亚铁,反应的离子方程式为Fe+2Fe3+=3Fe2+,故答案为:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;
(4)令MgO和Fe2O3的物质的量分别为xmol、ymol,则40x+160y=20,溶液C为MgCl2、FeCl3、HCl混合溶液,加入铁粉后生成的氢气为![]() =0.05mol,根据氯元素守恒,2x+3×2y+0.05×2=0.15×6,解得:x=0.1,y=0.1;n(Mg2+)=n(MgO)=0.1mol,所以c(Mg2+)=
=0.05mol,根据氯元素守恒,2x+3×2y+0.05×2=0.15×6,解得:x=0.1,y=0.1;n(Mg2+)=n(MgO)=0.1mol,所以c(Mg2+)=![]() =0.67mol/L;溶液D为MgCl2、FeCl2的混合溶液,根据电荷守恒溶液中2c(Mg2+)+2c(Fe2+)=c(Cl-),所以2×0.67mol/L+2c(Fe2+)=6mol/L,解得c(Fe2+)=2.33mol/L,故答案为:0.67mol/L;2.33mol/L。
=0.67mol/L;溶液D为MgCl2、FeCl2的混合溶液,根据电荷守恒溶液中2c(Mg2+)+2c(Fe2+)=c(Cl-),所以2×0.67mol/L+2c(Fe2+)=6mol/L,解得c(Fe2+)=2.33mol/L,故答案为:0.67mol/L;2.33mol/L。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案