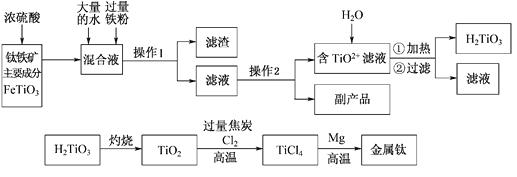
��Ŀ����
����Ŀ����������ЧӦ����Դ��ȱ�����⣬��ν��ʹ����е�CO2���������Կ������ã������˸������ձ����ӡ�Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)����ͼ��ʾ�÷�Ӧ���й����������ı仯��
CH3OH(g)+H2O(g)����ͼ��ʾ�÷�Ӧ���й����������ı仯��

(1)���ڸ÷�Ӧ������˵���У���ȷ����_______��
A����H>0����S>0�� B����H>0����S<0�� C����H<0����S<0�� D����H<0����S>0��
(2)��ͼ����������ߵ����͵�֮��IJ�ֵ����___________��
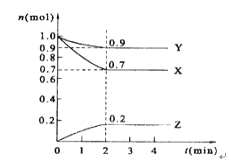
(3)Ϊ̽����Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L���ܱ������У�����1mol CO2��3mol H2�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ���ӷ�Ӧ��ʼ��ƽ�⣬������Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(H2) _________mol��L-1��min-1��

���𰸡�C�淴Ӧ�Ļ��0.225
��������
��1����ͼ1��֪����Ӧ�����������������������������÷�ӦΪ���ȷ�Ӧ������H��0���ɷ���ʽ��֪���÷�Ӧ����Ӧ����������ʵ�����С�ķ�Ӧ��������ӦΪ�ؼ����̣�����S��0����ѡC��
��2����ߵ��ʾ�Ļ״̬����������͵��Ǽ״���ˮ�����������ߵ�������������Ǽ״���ˮ��Ӧ���ɶ�����̼�������Ļ�ܣ����÷�Ӧ���淴Ӧ�Ļ�ܣ�
��3����ͼ��֪��10min��ƽ��ʱ�״���Ũ�ȱ仯��Ϊ0.75mol/L������v(CH3OH)=0.75mol.L-1/10min=0.075mol/(Lmin)������֮�ȵ��ڻ�ѧ������֮�ȣ�����v(H2)=3v(CH3OH)=3��0.075mol/(Lmin)=0.225mol/(Lmin)��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���±���A��B�����л�����й���Ϣ��
A | B |
������ģ��Ϊ�� ����ʹ������Ȼ�̼��Һ��ɫ�� ��������Ǻ���ʯ�ͻ���ˮƽ�ı�־�� | ����C��H��O����Ԫ����ɣ��dz����еij�����ζ���� ��ˮ��Һ��ʹ��ɫʯ����Һ��졣 |
���ݱ�����Ϣ�ش��������⣺
(1)����A������˵���У�����ȷ����__________(����)��
a�������ﺬ��̼̼˫�� b�����������е�ԭ�ӹ�ƽ�� c���ṹ��ʽΪCH2-CH2
(2)A��H2�����ӳɷ�Ӧ������X����X�ڷ�����ɺͽṹ�����Ƶ��л�����һ���࣬���ǵ�ͨʽΪCnH2n+2����n=_________ʱ�������ǻ��↑ʼ����ͬ���칹�ݡ�
(3)B���Ҵ���Ӧ�Ļ�ѧ����ʽΪ_____________����Ӧ����Ϊ_______________��
(4)��AΪԭ�Ͽ�ֱ������һ�ָ߷��ӻ�����P����P�Ľṹ��ʽΪ_______________��
����Ŀ����T���£��ֱ��������ݻ�Ϊ10L�ĺ��ݾ����ܱ������У�������Ӧ��2CO(g)+SO2(g)![]() S(g)+2CO2(g) ��H>0���������������±���ʾ��
S(g)+2CO2(g) ��H>0���������������±���ʾ��
���� | ��ʼʱ���ʵ���/mol | ƽ��ʱCO2(g)�����ʵ���/mol | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
�� | 1 | 0.5 | 0.5 | 0 | a |
�� | 1 | 0.5 | 0 | 0 | 0.8 |
�� | 2 | 1 | 0 | 0 | b |
����˵����ȷ����
A. �����������䣬�����Ҵﵽƽ����ٳ�����ϵ�����������1mol��ƽ�������ƶ�
B. b��1.6
C. ƽ�ⳣ����K��>K��
D. �����������䣬���������ٳ���1mol CO��ƽ�ⳣ����K������
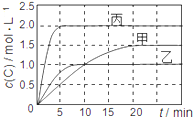
����Ŀ����ס��ҡ��������ܱ������г���һ������A��B��������Ӧ��xA(g)��B(g)![]() 2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ����±�����ͼ��ʾ��
2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ����±�����ͼ��ʾ��
���� | �� | �� | �� |
�ݻ� | 1L | 1L | 2L |
�¶� | T1 | T2 | T2 |
��Ӧ�� ��ʼ�� | 1molA 2molB | 1molA 2molB | 4molA 8molB |
����˵����ȷ���� �� ��
A. ��ͼ��֪��T1��T2���Ҹ÷�ӦΪ���ȷ�Ӧ
B. T1ʱ�÷�Ӧ��ƽ�ⳣ��K=7.2
C. ǰ10min�ס��ҡ�������������A��ƽ����Ӧ���ʣ�v(A)����v(A)����v(A)��
D. ƽ��ʱA������m��m����m����m��