题目内容
Fe3+可以与SCN-、CN-、F-有机分子等形成很多的配合物。
(1)写出基态Fe3+的核外电子排布式 。
(2)CN-中碳原子的杂化方式为 。
(3)已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 。
(4)写出一种与SCN-互为等电子体的分子 。(用化学式表示)
(5)下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。
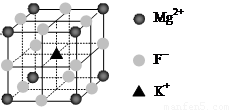
(6)F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为 。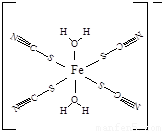
【答案】
(12分)每空2分
(1)[Ar]3d5 (2) sp (3)4∶3 (4)CS2或CO2
(5)

(6)KMgF3
【解析】
试题分析:(1)根据所学知识,Fe3+的核外电子排布式为[Ar]3d5。(2)CN-中C原子价层电子对个数="1+(1/2)"
(4+1-1×3)=2,所以采取sp杂化。(3)(CN)2中π键和σ键的个数比为4∶3。(4)SCN-价电子数为16,原子数为3,其等等电子体分子有CS2或CO2。(5)观察图像得知,N、C和S都达到了8电子结构,故该配合物中的配位键为 。(6)观察图像得,Mg2+为立方体的顶点,个数为8×(1/8)=1,K+位于中心,个数为1,F-位于边中间,个数为12×(1/4)=3,故该晶体的化学式为KMgF3。
。(6)观察图像得,Mg2+为立方体的顶点,个数为8×(1/8)=1,K+位于中心,个数为1,F-位于边中间,个数为12×(1/4)=3,故该晶体的化学式为KMgF3。
考点:配合物的成键情况;共价键的形成及共价键的主要类型;等电子体;晶胞的计算
点评:本题考查较为综合,设计配位键、晶胞的计算等知识,题目难度中等,注意原子核外电子排布与物质性质的关系,当价层电子轨道处于全空、全充满、半充满时,较稳定。

练习册系列答案
相关题目


 NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度