题目内容
能证明硅酸的酸性弱于碳酸酸性的实验事实是
| A.CO2溶于水形成碳酸,SiO2难溶于水 |
| B.CO2通入可溶性硅酸盐中析出硅酸沉淀 |
| C.高温下SiO2与碳酸盐反应生成CO2 |
| D.HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀 |
B
解析试题分析:比较酸性强弱可以根据强酸制弱酸的方法;A.错误;B.二氧化碳先与水反应生成碳酸,碳酸再与硅酸钠反应生成硅酸,正确;C.错误;D.只能说明HCl比碳酸强;HCl比硅酸强,并没有比较碳酸与硅酸的酸性关系。
考点: 比较酸性强弱的方法

练习册系列答案
相关题目
向1.00L0.3mol·L-NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,有关该溶液
的说法正确的是
| A.溶质为Na2CO3 |
B.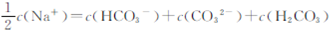 |
C.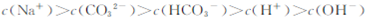 |
D.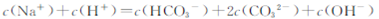 |
绿色化学要求利用化学反应原理从源头上消除污染。以铜为原料制备硫酸铜,下列四种原理设计,其中最能体现“绿色化学”要求的是
A.Cu +2H2SO4(浓)  CuSO4 +SO2↑+2H2O CuSO4 +SO2↑+2H2O |
B.Cu +Cl2 CuCl2,CuCl2+ H2SO4(浓) CuCl2,CuCl2+ H2SO4(浓)  CuSO4 +2HCl↑ CuSO4 +2HCl↑ |
C.Cu + H2SO4 +H2O2 CuSO4 +2H2O CuSO4 +2H2O |
D.3Cu +8HNO3=3Cu(NO3)2 +2NO↑+4H2O,Cu(NO3)2+H2SO4(浓)  CuSO4 +2HNO3↑ CuSO4 +2HNO3↑ |
下列有关物质的性质与应用不相对应的是
| A.Na2O2能分别与H2O、CO2反应产生氧气,可用作供氧剂 |
| B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂 |
| C.K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水 |
| D.液氨气化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 |
下列物质中,属于同素异形体的是
| A.S2和S4 | B.CO和CO2 | C. 和 和 | D.H2和D2 |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是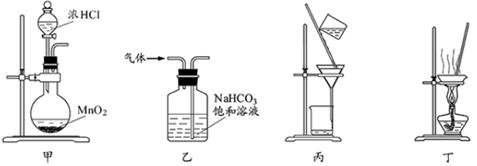
| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中的少量氯化氢 |
| C.用装置丙分离二氧化锰和氯化锰溶液 |
| D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O |
下列说法中正确的是
| A.硅主要以单质、氧化物、硅酸盐的形式存在于自然界中 |
| B.青铜是我国使用最早的合金,钢是用量最大、用途最广泛的合金 |
| C.铁容器可以盛放浓盐酸、浓硝酸、浓硫酸 |
| D.漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂 |
下列说法正确的是
| A.煤的干馏、石油的分馏都是物理变化 |
| B.工业上常用澄清石灰水和氯气反应制漂白粉 |
| C.蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析” |
| D.二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路” |
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
己知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O
对实验现象的“解释或结论”正确的是
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 氧化性:Cl2 > Fe3+ |