МвДїДЪИЭ
ЎѕМвДїЎї1915ДкЕµ±ґ¶ыОпАнС§Ѕ±КЪУиHenry BraggєНLawrence BraggЈ¬ТФ±нХГЛыГЗУГXЙдПЯ¶Фѕ§МеЅб№№µД·ЦОцЛщЧчµД№±ПЧЎЈїЖС§јТНЁ№эXЙдПЯНЖІвµЁ·ЇЦРјИє¬УРЕдО»јьЈ¬УЦє¬УРЗвјьЈ¬ЖдЅб№№КѕТвНјїЙјтµҐ±нКѕИзНјЈ¬ЖдЦРЕдО»јьєНЗвјьѕщбЉУГРйПЯ±нКѕЎЈ
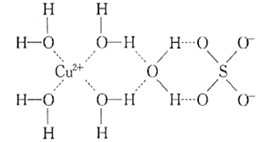
(1)РґіцУлCuФЪН¬Т»ЦЬЖЪЗТОґіЙ¶ФµзЧУКэЧо¶аµД»щМ¬ФЧУµДµзЧУЕЕІјКЅЈє______ Ј¬SФЧУµДјЫІгµзЧУЕЕІјНј______________ЎЈ
(2)РґіцµЁ·Їѕ§МеЦРЛ®єПНАлЧУµДЅб№№јтКЅ______________(±ШРлЅ«ЕдО»јь±нКѕіцАґ)ЎЈ
(3)ПтµЁ·ЇИЬТєЦРµОјУ°±Л®ЦБ№эБїЈ¬ЧоЦХµГµЅЙоА¶Й«µДНёГчИЬТєЈ¬ФЩјУИлТТґјєуОціцЙоА¶Й«ѕ§МеЈ¬РґіцЙъіЙЙоА¶Й«НёГчИЬТєµДАлЧУ·ЅіМКЅ__________ЎЈ±ИЅПNH3єН[Cu(NH3)4]2+ЦРH-N-H ЦРјьЅЗµДґуРЎЈєNH3______[Cu(NH3)4]2+(МоЎ°ЈѕЎ± Ў°ЈјЎ± »тЎ°=Ў±)ЎЈ
(4)ТСЦЄH2O2µДЅб№№ИзНјЈє
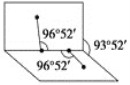
H2O2·ЦЧУІ»КЗЦ±ПЯРОµДЈ¬БЅёцHФЧУУМИзФЪ°лХ№їЄµДКйµДБЅГжЦЅЙПЈ¬КйТіЅЗОЄ93Ўг52ЎдЈ¬¶шБЅёцOЎЄHјьУлOЎЄOјьµДјРЅЗѕщОЄ96Ўг52ЎдЈ¬№АјЖЛьДСИЬУЪCS2Ј¬јтТЄЛµГчФТт__________________________ЎЈ
(5)Co3+РОіЙµД»ЇєПОп[Co(NH3)5N3]SO4ЦРCoµДЕдО»КэОЄ_____ЎЈ
Ўѕґр°ёЎї1s22s22p63s23p63d54s1»т[Ar]3d54s1 ![]()
 Cu(OH)2+4NH3 Ў¤H2OЈЅ[Cu(NH3)4]2++2OH-+4H2O < ТтH2O2ОЄј«РФ·ЦЧУЈ¬¶шCS2ОЄ·Зј«РФИЬјБЈ¬ёщѕЭПаЛЖПаИЬ№жВЙЈ¬H2O2ДСИЬУЪCS2ЦР 6
Cu(OH)2+4NH3 Ў¤H2OЈЅ[Cu(NH3)4]2++2OH-+4H2O < ТтH2O2ОЄј«РФ·ЦЧУЈ¬¶шCS2ОЄ·Зј«РФИЬјБЈ¬ёщѕЭПаЛЖПаИЬ№жВЙЈ¬H2O2ДСИЬУЪCS2ЦР 6
ЎѕЅвОцЎї
ЈЁ1Ј©CuµДФЧУРтКэОЄ29Ј¬µзЧУЕЕІјКЅОЄ1s22s22p63s23p63d104s1»т[Ar]3d104s1Ј»SµДФЧУРтКэОЄ16Ј¬µзЧУЕЕІјКЅОЄ1s22s22p63s23p3Ј»
ЈЁ2Ј©µЁ·Їѕ§МеЦРНАлЧУє¬УРїХ№мµАЈ¬Л®·ЦЧУє¬УР№В¶ФµзЧУ¶ФЈ¬НАлЧУУлЛ®·ЦЧУЦ®јдРОіЙЕдО»јьЈ»
ЈЁ3Ј©ПтµЁ·ЇИЬТєЦРµОјУ°±Л®Ј¬БтЛбНУл°±Л®·ґУ¦ЙъіЙЗїСх»ЇНіБµнЈ¬ЗвСх»ЇНіБµнИЬУЪ№эБїµД°±Л®ЙъіЙє¬УРЙоА¶Й«Н°±ВзАлЧУµДНёГчИЬТєЈ»ТтОЄNH3Мṩ№В¶ФµзЧУУлCu2+РОіЙЕдО»јьєуЈ¬N-HіЙјьµзЧУ¶ФКЬµЅµДЕЕівБ¦јхРЎЈ¬µјЦВH-N-HјьЅЗФцґуЈ»
ЈЁ4Ј©ПаЛЖПаИЬФАнКЗЦёУЙУЪј«РФ·ЦЧУјдµДµзРФЧчУГЈ¬К№µГј«РФ·ЦЧУЧйіЙµДИЬЦКТЧИЬУЪј«РФ·ЦЧУЧйіЙµДИЬјБЈ¬ДСИЬУЪ·Зј«РФ·ЦЧУЧйіЙµДИЬјБЈ¬·Зј«РФ·ЦЧУЧйіЙµДИЬЦКТЧИЬУЪ·Зј«РФ·ЦЧУЧйіЙµДИЬјБЈ¬ДСИЬУЪј«РФ·ЦЧУЧйіЙµДИЬјБЈ»
ЈЁ5Ј©УЙ»ЇєПОпµД»ЇС§КЅОЄ[Co(NH3)5N3]SO4їЙЦЄЈ¬БтЛбёщАлЧУОЄЕдєПОпµДНвЅзЈ¬[Co(NH3)5N3]2+ОЄДЪЅзЈ¬ДЪЅзЦРCo3+ОЄЦРРДАлЧУЈ¬NH3єНN3ЎЄОЄЕдМеЎЈ
ЈЁ1Ј©CuµДФЧУРтКэОЄ29Ј¬µзЧУЕЕІјКЅОЄ1s22s22p63s23p63d104s1»т[Ar]3d104s1Ј»SµДФЧУРтКэОЄ16Ј¬µзЧУЕЕІјКЅОЄ1s22s22p63s23p3Ј¬јЫІгµзЧУЕЕІјНјОЄ![]() Ј¬№Кґр°ёОЄЈє1s22s22p63s23p63d54s1»т[Ar]3d54s1Ј»
Ј¬№Кґр°ёОЄЈє1s22s22p63s23p63d54s1»т[Ar]3d54s1Ј»![]() Ј»
Ј»
ЈЁ2Ј©µЁ·Їѕ§МеЦРНАлЧУє¬УРїХ№мµАЈ¬Л®·ЦЧУє¬УР№В¶ФµзЧУ¶ФЈ¬НАлЧУУлЛ®·ЦЧУЦ®јдРОіЙЕдО»јьЈ¬НАлЧУЕдМеКэОЄ4Ј®Л®єПНАлЧУµДЅб№№јтКЅОЄ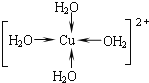 Ј¬№Кґр°ёОЄЈє
Ј¬№Кґр°ёОЄЈє Ј»
Ј»
ЈЁ3Ј©ПтµЁ·ЇИЬТєЦРµОјУ°±Л®Ј¬БтЛбНУл°±Л®·ґУ¦ЙъіЙЗїСх»ЇНіБµнЈ¬ЗвСх»ЇНіБµнИЬУЪ№эБїµД°±Л®ЙъіЙє¬УРЙоА¶Й«Н°±ВзАлЧУµДНёГчИЬТєЈ¬·ґУ¦µДАлЧУ·ЅіМКЅОЄЈєCuЈЁOHЈ©2+4NH3H2O=[CuЈЁNH3Ј©4]2++2OH-+4H2OЈ»ТтОЄNH3Мṩ№В¶ФµзЧУУлCu2+РОіЙЕдО»јьєуЈ¬N-HіЙјьµзЧУ¶ФКЬµЅµДЕЕівБ¦јхРЎЈ¬µјЦВH-N-HјьЅЗФцґуЈ¬№Кґр°ёОЄЈєCuЈЁOHЈ©2+4NH3H2O=[CuЈЁNH3Ј©4]2++2OH-+4H2OЈ»<Ј»
ЈЁ4Ј©ПаЛЖПаИЬФАнКЗЦёУЙУЪј«РФ·ЦЧУјдµДµзРФЧчУГЈ¬К№µГј«РФ·ЦЧУЧйіЙµДИЬЦКТЧИЬУЪј«РФ·ЦЧУЧйіЙµДИЬјБЈ¬ДСИЬУЪ·Зј«РФ·ЦЧУЧйіЙµДИЬјБЈ¬·Зј«РФ·ЦЧУЧйіЙµДИЬЦКТЧИЬУЪ·Зј«РФ·ЦЧУЧйіЙµДИЬјБЈ¬ДСИЬУЪј«РФ·ЦЧУЧйіЙµДИЬјБЈ¬УЙНјїЙЦЄЛ«СхЛ®КЗТ»ЦЦє¬УРСхСх№ІјЫјьєНСхЗв№ІјЫјьµДј«РФ·ЦЧУЈ¬CS2КЗ·Зј«РФ·ЦЧУЈ¬ТАѕЭПаЛЖПаИЬµДФАнїЙЦЄЈ¬H2O2ДСИЬУЪCS2Ј¬№Кґр°ёОЄЈєТтH2O2ОЄј«РФ·ЦЧУЈ¬¶шCS2ОЄ·Зј«РФИЬјБЈ¬ёщѕЭПаЛЖПаИЬ№жВЙЈ¬H2O2ДСИЬУЪCS2ЦРЈ»
ЈЁ5Ј©УЙ»ЇєПОпµД»ЇС§КЅОЄ[Co(NH3)5N3]SO4їЙЦЄЈ¬БтЛбёщАлЧУОЄЕдєПОпµДНвЅзЈ¬[Co(NH3)5N3]2+ОЄДЪЅзЈ¬ДЪЅзЦРCo3+ОЄЦРРДАлЧУЈ¬NH3єНN3ЎЄОЄЕдМеЈ¬ЕдО»КэОЄ6Ј¬№Кґр°ёОЄЈє6ЎЈ

 С§П°КµјщФ°µШПµБРґр°ё
С§П°КµјщФ°µШПµБРґр°ёЎѕМвДїЎїИзПВ±нЛщКѕОЄФЄЛШЦЬЖЪ±нµДТ»Ії·ЦЈ¬ІОХХФЄЛШўЩЎ«ўЯФЪ±нЦРµДО»ЦГЈ¬Зл»ШґрПВБРОКМвЈє
Че ЦЬЖЪ | IA | 0 | ||||||
1 | ўЩ | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ўЪ | ўЫ | ||||||
3 | ўЬ | ўЭ | ўЮ | ўЯ | ||||
ЈЁ1Ј©ўЫўЬўЯµДФЧУ°лѕ¶УЙґуµЅРЎµДЛіРтОЄ____ЈЁУГФЄЛШ·ыєЕ±нКѕЈ©ЎЈ
ЈЁ2Ј©ўЮєНўЯµДЧоёЯјЫє¬СхЛбµДЛбРФЗїИхОЄ____ЈЁУГЛбµД»ЇС§КЅ±нКѕЈ©ЎЈ
ЈЁ3Ј©ўЪўЬБЅЦЦФЄЛШ°ґФЧУёцКэЦ®±ИОЄ1Јє1ЧйіЙµД»ЇєПОпµДµзЧУКЅ____ЎЈ
ЈЁ4Ј©ўЩўЪБЅЦЦФЄЛШ°ґФЧУёцКэЦ®±ИОЄ1Јє1ЧйіЙµДіЈјыТєМ¬»ЇєПОпЈ¬ФЪЛбРФИЬТєЦРДЬЅ«Fe2+Сх»ЇЈ¬РґіцёГ·ґУ¦µДАлЧУ·ЅіМКЅ___ЎЈ
ЈЁ5Ј©±нЦРўЭµДµҐЦКєНўЬµДЧоёЯјЫСх»ЇОпЛ®»ЇОп·ґУ¦µД»ЇС§·ЅіМКЅОЄ____ЎЈ