题目内容
【题目】已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH—O共价键放出463kJ的热量。反应2H2(g)+O2(g)=2H2O(g)的能量变化如右图所示。下列说法正确的是

A. 2H(g)→H2(g) ![]() H >0
H >0
B. 图中E1 = 932kJ
C. 图中E2 = 926 kJ
D. 2H2(g)+O2(g)=2H2O(g) ![]() H =-484 kJ·mol-1
H =-484 kJ·mol-1
【答案】D
【解析】A、形成氢氢键放出热量,△H<0,选项A错误;B、根据图中信息可得E1 = 2×436 kJ +496 kJ =1368kJ,选项B错误;C、根据图中信息可得E2 = 4×463 kJ =1852kJ,选项C错误;D、2H2(g)+O2(g)=2H2O(g) ![]() H =(E1 – E2)/mol=(1368 kJ -1852 kJ)/mol=-484 kJ·mol-1,选项D正确。答案选D。
H =(E1 – E2)/mol=(1368 kJ -1852 kJ)/mol=-484 kJ·mol-1,选项D正确。答案选D。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】到目前为止人们已发现或合成了118种元素,元素①~⑨在周期表中的位置如下表所示(序号代表对应的元素)。
① | |||||||||||||||||
② | ③ | ④ | ⑤ | ||||||||||||||
⑥ | ⑦ | ⑧ | ⑨ | ||||||||||||||
…… | |||||||||||||||||
(1)④在周期表中位于第___________周期___________族。
(2)9种元素中原子半径最大的是___________(填元素符号),非金属性最强的是___________(填元素符号);
(3)最高价氧化物的水化物的碱性⑥___________⑦(填“>”或“<”)。
(4)⑧的阴离子的结构示意图为___________;③的简单氢化物与⑨的最高价氧化物的水化物化合生成的盐的化学式为___________。
(5)能说明⑨的非金属性比③强的化学方程式为___________。
(6)1971年在星际空间发现一种由①、②、③三种元素组成的直线型有机分子X。X的摩尔质量为51g·mol-1,且X分子中共含5个原子(各原子均满足稀有气体原子的稳定结构),X的结构式为___________。
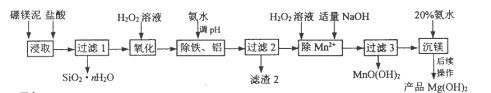
【题目】以硼镁泥(主要成分为MgSiO3、Fe2O3及少量Al2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如下:
己知:
①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:
pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
开始沉淀时 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
沉淀完全时 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。
(1)“浸取”时,为提高镁的浸取率可行的措施为__________。
a.将硼镁泥制成浆料 b.降低浸取温度 c.用盐酸多次浸取
(2)“浸取”时,MgSiO3与盐酸反应的化学方程式为_________________________。
(3)“除铁、铝”时,需调节溶液pH范围为_________________________。
(4)“除Mn2+”时发生反应的离子方程式为_________________________;
过滤3所得滤渣中含有MnO(OH)2和__________。
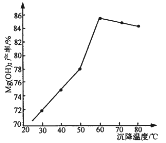
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是________________。