题目内容
【题目】质量为ag的铜片在空气中灼烧变黑,趁热放入下列物质中铜丝变为红色,而且质量仍为ag的是( )
①硝酸②无水乙醇③盐酸④CO⑤H2
A.①②④B.②④⑤C.②⑤D.①④⑤
【答案】B
【解析】
①铜丝灼烧成黑色CuO,立即放入硝酸中,CuO与硝酸反应生成可溶性Cu(NO3)2,铜片质量减少,故①不符合题意;
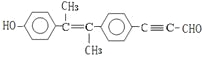
②铜丝灼烧成黑色CuO,立即放入乙醇中,CuO与乙醇反应:CuO+C2H5OH![]() CH3CHO+Cu+H2O,反应前后铜片质量不变,故②符合题意;
CH3CHO+Cu+H2O,反应前后铜片质量不变,故②符合题意;
③铜丝灼烧成黑色CuO,立即放入盐酸中,CuO与盐酸反应,生成可溶性CuCl2,铜片质量减少,故③不符合题意;
④铜丝灼烧成黑色CuO,立即放入CO中,CuO与CO反应:CuO+CO![]() Cu+CO2,反应前后铜片质量不变,故④符合题意;
Cu+CO2,反应前后铜片质量不变,故④符合题意;
⑤铜丝灼烧成黑色CuO,立即放入H2中,CuO与H2反应:CuO+ H2![]() Cu+H2O,反应前后铜片质量不变,故⑤符合题意;
Cu+H2O,反应前后铜片质量不变,故⑤符合题意;
符合题意的是②④⑤,故答案为B。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】铁及其化合物之间的相互转化可用下式表示:Fe2+![]() Fe3+
Fe3+![]() FeO42-(高铁酸根离子)。回答下列有关问题:
FeO42-(高铁酸根离子)。回答下列有关问题:
(1)Fe与过量盐酸反应可以制取FeCl2。若用反应所得的酸性溶液,实现上述①、④的转化,要求产物纯净,可选用__________(填字母)。
a.Cl2 b.Fe c.Cu d.KMnO4
(2)如下化学方程式中:Fe2O3+3NaClO+4KOH=2K2FeO4(高铁酸钾)+3NaCl+2H2O,还原剂是______________,具有__________性。
(3)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是___________、__________。
(4)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在试管Ⅰ中滴入酸性高锰酸钾溶液,在试管Ⅱ中滴入KSCN溶液。
①请你填出该同学实验中出现以下现象时应得出的结论:
实验现象 | 试管Ⅰ | 试管Ⅱ | 结论 |
a | 褪色 | 不变红 | ___ |
b | 不褪色 | 变红 | ___ |
c | 褪色 | 变红 | ___ |
②能不能将KMnO4和KSCN滴入到同一试管中进行验证,为什么?试进行解释:________。