题目内容
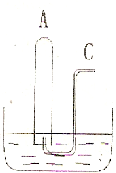 如图所示:在B水槽中装有500mL水,容积为amL的试管A 充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中.充分反应后,试管A中余下气体的体积为0.5a mL,则原混合气体中NO2和NO的物质的量之比为
如图所示:在B水槽中装有500mL水,容积为amL的试管A 充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中.充分反应后,试管A中余下气体的体积为0.5a mL,则原混合气体中NO2和NO的物质的量之比为3:1
3:1
;通过导气管C往余下0.5a mL 气体的试管A中持续通入氧气,A 中可能观察到的现象是:无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体
无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体
.当试管A中充满气体时停止通入氧气,然后将试管取出水槽,则共通入氧气的体积为| 11 |
| 8 |
| 11 |
| 8 |
| a |
| 11200 |
| a |
| 11200 |
分析:(1)发生3NO2+2H2O=2HNO3+NO,导致气体的体积减小,根据气体体积减小,利用差量法计算二氧化氮的体积,进而计算NO的体积,体积之比等于物质的量之比;
(2)剩余NO,持续通入氧气,会发生,4NO+3O2+2H2O=4HNO3无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体;
(3)试管A中充满气体时停止通入氧气,完全为氧气,发生反应4NO+3O2+2H2O=4HNO3,令通入氧气为xL,则参加反应的氧气为(x-a)mL,根据方程式计算;
(4)根据氮元素守恒,氮元素守恒可知n(HNO3)=n(NO2)+n(NO),再根据c=
计算所得硝酸的浓度.
(2)剩余NO,持续通入氧气,会发生,4NO+3O2+2H2O=4HNO3无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体;
(3)试管A中充满气体时停止通入氧气,完全为氧气,发生反应4NO+3O2+2H2O=4HNO3,令通入氧气为xL,则参加反应的氧气为(x-a)mL,根据方程式计算;
(4)根据氮元素守恒,氮元素守恒可知n(HNO3)=n(NO2)+n(NO),再根据c=
| n |
| V |
解答:解:(1)充满了NO2和NO的混合气体(标准状况)试管A倒水中.充分反应后,试管A中余下气体的体积为0.5a mL,则:
3NO2+2H2O=2HNO3+NO,体积减少△V
3 2
V(NO2) amL-0.5amL=0.5amL
故V(NO2)=
=0.75amL,则V(NO)=amL-0.75amL=0.25mL,
故n(NO2):n(NO)=V(NO2):V(NO)=0.75amL:0.25mL=3:1,
故答案为:3:1;
(2)剩余NO,持续通入氧气,会发生4NO+3O2+2H2O=4HNO3,无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体,
故答案为:无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体;
(3)试管A中充满气体时停止通入氧气,完全为氧气,令通入氧气为xL,则:
4NO+3O2+2H2O=4HNO3
4 3
0.5amL (x-a)mL
所以4:3=0.5amL:(x-a)mL
解得:x=
a,
故答案为:
a;
(4)V(NO2)=0.75amL,氮元素守恒可知n(HNO3)=n(NO2)+n(NO)=
×10-3mol,
故c(HNO3)=
=
mol/L,
故答案为:
.
3NO2+2H2O=2HNO3+NO,体积减少△V
3 2
V(NO2) amL-0.5amL=0.5amL
故V(NO2)=
| 0.5amL×3 |
| 2 |
故n(NO2):n(NO)=V(NO2):V(NO)=0.75amL:0.25mL=3:1,
故答案为:3:1;
(2)剩余NO,持续通入氧气,会发生4NO+3O2+2H2O=4HNO3,无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体,
故答案为:无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体;
(3)试管A中充满气体时停止通入氧气,完全为氧气,令通入氧气为xL,则:
4NO+3O2+2H2O=4HNO3
4 3
0.5amL (x-a)mL
所以4:3=0.5amL:(x-a)mL
解得:x=
| 11 |
| 8 |
故答案为:
| 11 |
| 8 |
(4)V(NO2)=0.75amL,氮元素守恒可知n(HNO3)=n(NO2)+n(NO)=
| a |
| 22.4 |
故c(HNO3)=
| ||
| 0.5L |
| a |
| 11200 |
故答案为:
| a |
| 11200 |
点评:本题考查混合物有关计算、氮的氧化物性质等,难度中等,注意根据方程式进行计算.

练习册系列答案
相关题目
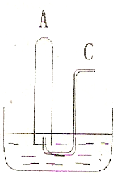 如图所示:在B水槽中装有500mL水,容积为amL的试管A 充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中.充分反应后,试管A中余下气体的体积为0.5a mL,则原混合气体中NO2和NO的物质的量之比为________;通过导气管C往余下0.5a mL 气体的试管A中持续通人氧气,A 中可能观察到的现象是:________.当试管A中充满气体时停止通入氧气,然后将试管取出水槽,则共通入氧气的体积为________mL,水槽B中溶液的物质的量浓度为________mol?L-1(设溶液的体积仍为500mL)
如图所示:在B水槽中装有500mL水,容积为amL的试管A 充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中.充分反应后,试管A中余下气体的体积为0.5a mL,则原混合气体中NO2和NO的物质的量之比为________;通过导气管C往余下0.5a mL 气体的试管A中持续通人氧气,A 中可能观察到的现象是:________.当试管A中充满气体时停止通入氧气,然后将试管取出水槽,则共通入氧气的体积为________mL,水槽B中溶液的物质的量浓度为________mol?L-1(设溶液的体积仍为500mL)



