题目内容
用氨碱法生产NH4Cl 和Na2CO3的主要过程是:在饱和NaCl 溶液中,先通入足量的NH3气体,然后再通入足量的CO2气体,析出NaHCO3晶体。主要反应有三步:NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl=NH4Cl+NaHCO3↓
2NaHCO3
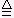 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O若反应过程中无损失,CO2可重复使用。
(1)通入的NH3和 CO2最适宜的体积比是(同温同压下)__________。
(2)实际生产中,反应过程中需补充H2O和NaCl,补充H2O和NaCl的物质的量之比是______________。
(1)2∶1
(2)1∶2
【试题分析】

练习册系列答案
相关题目
(5分)某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质。为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5 g纯碱样品放人烧杯中,将烧杯放在电子称上,再把150.0 g稀盐酸(足量)加入样品中。观察读数变化如下表所示:
| 时间/s | 0 | 5 | 10 | 15 |
| 读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
请你据此分析计算:
(1)该产品中碳酸钠的质量分数?(结果精确到0。l%)
(2)若反应后溶液为150.0 mL,计算溶液中NaCI物质的量浓度。
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质。为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5 g纯碱样品放入烧杯中,将烧杯放在电子天平上,再把150.0 g稀盐酸(足量)加入样品中。观察读数变化如下表所示:
| 时间/s | 0 | 5 | 10 | 15 |
| 读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
(1)实验中产生的CO2气体质量为 ;
(2)该产品中碳酸钠的质量分数 (结果精确到小数点后一位) 。