题目内容
18.碳元素在生产生活中具有非常重要的作用,在新物质的制备中也发挥了举足轻重的作用.(1)与碳同周期,且基态原子的核外未成对电子数相等的元素是O(写出元素符号).
(2)石墨烯是目前人们制造的新物质,该物质是由单层碳原子六边形平铺而成的,像一张纸一样(如图甲),石墨烯中碳原子的杂化方式为sp2;常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是甲醇分子间存在氢键,而丙烯分子间只有范德华力.
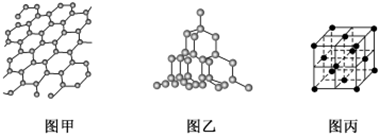
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子.观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O形成的最小环上O原子数目是6.
(4)图丙是C60的晶胞模型(一个小黑点代表一个C60分子),图中显示出的C60分子数为14个.实际上一个C60晶胞中含有4个C60分子.
分析 (1)C原子核外未成对电子数是2,与碳同周期,且基态原子的核外未成对电子数相等的元素是O元素;(2)石墨烯中每个C原子价层电子对个数是3,根据价层电子对互斥理论判断C原子杂化类型;相同温度下,含有分子间氢键的物质熔沸点较高;
(3)金刚石中最小环上含有6个C原子,Si和金刚石结构相似,所以每个最小环上含有6个Si原子,二氧化硅晶体相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子,据此判断Si、O形成的最小环上O原子数目;
(4)每个晶胞中C60分子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$.
解答 解:(1)C原子核外未成对电子数是2,与碳同周期,说明处于第二周期,且基态原子的核外未成对电子数是2的元素是O元素,
故答案为:O;
(2)石墨烯中每个C原子价层电子对个数是3,根据价层电子对互斥理论知C原子杂化类型为sp2;相同温度下,含有分子间氢键的物质熔沸点较高,甲醇分子间形成氢键、丙烯分子间只存在范德华力,所以常温下甲醇是液态、丙烯是气态,
故答案为:sp2;甲醇分子间存在氢键,而丙烯分子间只有范德华力;
(3)金刚石中最小环上含有6个C原子,Si和金刚石结构相似,所以每个最小环上含有6个Si原子,二氧化硅晶体相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子,所以Si、O形成的最小环上O原子数目是6,故答案为:6;
(4)每个晶胞中C60分子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案为:4.
点评 本题考查物质结构和性质,涉及晶胞计算、原子杂化方式判断、氢键、原子核外电子排布等知识点,利用均摊法、价层电子对互斥理论等知识点即可解答,易错点是判断二氧化硅中最小环上O原子个数,题目难度不大.

| A. | 118 | B. | 175 | C. | 47 | D. | 293 |
| A. | H与D互为同位素;葡萄糖和蔗糖互为同系物 | |
| B. | 乙烷气体中混有乙烯,通入酸性高锰酸钾溶液,从而除去乙烯 | |
| C. | 元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素 | |
| D. | 证明CH3CH2CH=CHCH2CH2OH分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色 |
| A. | HCHO | B. | CH3OH | C. | HCOOC2H5 | D. | HCOOCH3 |
| A. | 原子半径:O<S<Na | B. | 稳定性:PH3>H2S>NH3 | ||
| C. | 电负性:P<S<Cl | D. | 第一电离能:Na<Al<Mg |
| A. | 乙烯、乙炔 | B. | 苯、四氯化碳 | C. | 乙烷、乙烯 | D. | 苯、酒精 |
| A. | 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜 | |
| B. | 乙醇能使蛋白质变性,可用75%的乙醇溶液作医疗消毒剂 | |
| C. | 油脂能发生皂化反应,可用热的烧碱溶液去除试管内壁油脂 | |
| D. | 淀粉能与单质碘发生显色反应,可用碘水鉴别淀粉和纤维素 |
 .
.