题目内容
【题目】在1 L密闭容器中,发生反应N2(g)+3H2(g)![]() 2NH3(g),若最初加入的N2和H2物质的量均为4 mol,测得10s内H2的平均速率v(H2)=0.12 molL-1s-1,则反应进行到10s时容器中N2的物质的量是
2NH3(g),若最初加入的N2和H2物质的量均为4 mol,测得10s内H2的平均速率v(H2)=0.12 molL-1s-1,则反应进行到10s时容器中N2的物质的量是
A.1.6molB.2.8molC.3.2molD.3.6mol
【答案】D
【解析】
根据在同一反应中,用不同物质表示反应速率时,速率比等于化学计量数的比可知v(N2)=![]() v(H2)=
v(H2)=![]() ×0.12 molL-1s-1=0.04 molL-1s-1,则N2反应消耗的物质的量为0.04 molL-1s-1×1L×10s=0.4mol,反应开始时N2的物质的量是4mol,所以10s时N2的物质的量为4mol-0.4mol=3.6mol,故合理选项是D。
×0.12 molL-1s-1=0.04 molL-1s-1,则N2反应消耗的物质的量为0.04 molL-1s-1×1L×10s=0.4mol,反应开始时N2的物质的量是4mol,所以10s时N2的物质的量为4mol-0.4mol=3.6mol,故合理选项是D。

【题目】I已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表(单位省略):
醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10-5 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka=6.2×10-10 |
(1)写出碳酸的第一步电离方程式___。
(2)25℃时,等浓度的三种溶液①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,pH由大到小的顺序为___(填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为___。
(4)将浓度为0.02mol/L的HCN与0.01mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是___。
a.c(H+)>c(OH-) b.c(H+)+c(HCN)=c(OH-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为___(填序号)。
Ⅱ.酸性高锰酸钾标准溶液是实验室常用的氧化还原滴定标准试剂。
(6)某同学用0.1000mol/L的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①滴定时,用___装KMnO4溶液。
②滴定到达终点的现象是___。
③用移液管吸取25.00m试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为___mol/L。
【题目】能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是________(填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能
(2)已知:
Ⅰ.H2(g)+![]() O2(g)=H2O(g) H1=-241.8kJmol-1
O2(g)=H2O(g) H1=-241.8kJmol-1
Ⅱ.H2(g)+![]() O2(g)=H2O(l) H2=-285.8kJmol-1
O2(g)=H2O(l) H2=-285.8kJmol-1
气态分子中的化学键 | 断开1 mol化学键所需的能量/kJ |
O-H | 465 |
O=O | 498 |
①氢气的燃烧热为________kJmol-1.
②断开1 mol H-H键需要吸收的能量为________kJ。
③36 g H2O(1)完全分解生成氧气和氧气,需要吸收________kJ的能量。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。
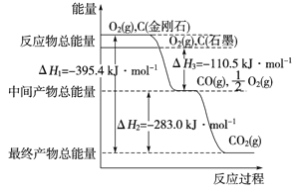
①在通常状况下,金刚石和石墨的稳定性较大的是________ (填“金刚石”或“石墨”)。
②12 g石墨在一定量空气中燃烧,生成36g气体,该过程放出的热量为________kJ。