题目内容
(08东莞调研)(10分)二元酸H2A的电离反应如下:
H2A ![]() HA- + H+ K1 = 4.50×10-7 HA-
HA- + H+ K1 = 4.50×10-7 HA-![]() A2- + H+ K2 = 4.70×10-11
A2- + H+ K2 = 4.70×10-11
用0.300 mol?L-1 HCl滴定含有Na2A和NaHA的一份20.00 mL的溶液,滴定进程用玻璃电极pH计跟踪,滴定曲线上的三个点对应的数据如下:
加入的HCl/mL | 1.00 | 10.00 | 28.00 |
pH | 10.33 | 8.34 | 6.35 |
(1)加入1.00 mL HCl时首先与HCl反应的溶质是 ,产物是 。
(2)(1)中生成的产物有 mol。
(3)写出(1)中生成的产物与溶剂反应的主要平衡式: 。
(4)当pH=8.34时反应混合物有两种溶质,而pH=6.35时反应混合物只有一种含钠化合物溶质,试计算起始溶液中存在的Na2A和NaHA的物质的量浓度?(忽略溶质的水解与电离,写出计算过程)
答案:(1)A2-,HA-(各1分)
(2)0.300 ×10-4mol(2分)
(3)HA- + H2O ![]() H2A + OH-(2分)
H2A + OH-(2分)
(4)解:当pH=8.34时反应混合物有两种溶质,则溶液中有NaCl和NaHA;
反应为 A2- + H+= HA-
1 mol 1 mol 1 mol
3.00×10-3 mol 0.3000 mol?L-1×10.00×10-3 L 3.00×10-3 mol
C(Na2A)= 3.00×10-3 mol /20.00×10-3 L= 0.15 0mol?L-1(3分)
pH=6.35时反应混合物只有一种含钠化合物溶质, 则溶液中有NaCl和H2A;
反应为 HA-+ H+= H2A
1 mol 1 mol 1 mol
5.40×10-3 mol 0.3000 mol?L-1×(28.00-10.00)×10-3 L 5.40×10-3 mol
CNaHA)=( 5.40×10-3-3.00×10-3) mol/20.00×10-3 L =0.120mol?L-1(3分)

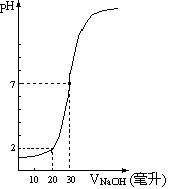 (08东莞调研)下图为10mL一定物质的量浓度的盐酸X,用一定物质的量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量的浓度是( )
(08东莞调研)下图为10mL一定物质的量浓度的盐酸X,用一定物质的量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量的浓度是( )
| A | B | C | D |
C(HCl)(mol/L) | 0.12 | 0.04 | 0.18 | 0.09 |
C(NaOH)(mol/L) | 0.04 | 0.12 | 0.06 | 0.03 |