题目内容
A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,A2-离子半径大于C-,B2+与C-具有相同的电子层结构。下列叙述中一定不正确的是 ( )
A.它们的原子序数A>B>C
B.它们的离子半径A2->C->B2+
C.它们的原子半径C>B>A
D.它们的最外层电子数C>A>B
C
解析试题分析:A、因B2+与C-具有相同的电子层结构且均为短周期元素,所以B为Mg、C为F、A为S,原子序数:A>B>C,B、离子半径:A2+>C->B2+;C、原子半径:B>A>C;D、最外层电子数:C>A>B。
考点:考查元素周期律,考查考生对元素周期律的掌握情况。

练习册系列答案
相关题目
据报道,用10B合成的10B20有较好的抗癌作用。下列叙述正确的是
| A.10B20是一种新型化合物 | B.10B的中子数和核外电子数相等 |
| C.10B20晶体熔点高,硬度大 | D.10B和10B20互为同位素 |
短周期元素X、Y、 Z、W在元素周期表中的位置如下表,且Z族元素的化合物种类最多。则下列说法正确的是
| | X | | Y |
| Z | | W | |
A.Z单质的熔点是四种单质中最低的
B.Y的最高价氧化物的水化物酸性最强
C.碳元素可与W形成直线型分子
D.ZY4是由极性键形成的极性分子
下列各组中的性质比较,不正确的是( )
| A.稳定性:NH3<PH3<SiH4 | B.酸性:HClO4>H2SO4>H3PO4 |
| C.碱性:KOH>NaOH>Mg(OH)2 | D.还原性:F-<Cl-<Br- |
五种短周期元素X、Y、Z、M、N的原子序数依次增大,X、Y、Z、M是组成蛋白质的基础元素,M原子的最外层电子数是电子层数的3倍,N2M2可用于潜水艇中作为氧气的来源,下列说法错误的是
| A.与Y同主族的短周期元素可与强碱反应生成氢气 |
| B.X和M形成的化合物分子中可能含有非极性共价键 |
| C.由X、Z、M形成的化合物一定是共价化合物 |
| D.等物质的量的N2YM3粉末和NXYM3粉末分别与等浓度的盐酸反应,后者反应速率要快 |
如图是两个氢原子相互接近时的能量变化图,则有关该图的说法正确的是( )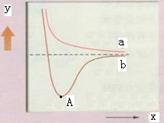
| A.y代表两原子之间的核间距 |
| B.x代表体系具有的能量 |
| C.a代表核外电子自旋相反的两个氢原子能量变化 |
| D.A点时表示两原子间形成了稳定的共价键 |
M、N为短周期的两种元素,M元素原于的最外层电子数≤4,N元素原子的最外层电子数>4,下列对其有关说法正确的是
| A.M、N可能为金属 |
| B.若M、N为同周期元素,则原于半径M<N |
| C.M、N元素的单质可能与水发生置换反应 |
| D.M、N形成的离子化合物不能体现强氧化性 |