题目内容
4.下列各组顺序的排列不正确的是( )| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 原子最外层电子数:F>S>Ca |
分析 A、同周期元素原子的半径从左到右依次减小;
B、同周期元素气态氢化物的稳定性从左到右逐渐增强;
C、根据同周期、同主族最高价含氧酸的递变规律可以得出正确判断;
D、最外层电子数等于主族的族序数.
解答 解:A.同周期元素原子的半径从左到右依次减小,则原子半径:Al<Mg<Na,故A错误;
B.同周期元素气态氢化物的稳定性从左到右逐渐增强,即热稳定性:HCl>H2S>PH3,故B正确;
C.同周期最高价氧化物对应水合物的酸性从左到右依次增强(Si、P同周期),同主族最高价氧化物对应水合物的酸性从上到下依次减弱(C、Si同主族),则酸性强弱:H2SiO4<H2CO3<H3PO4,故C正确;
D.F为第VIIA族,S为第VIA族,Ca为第IIA族,则原子最外层电子数:F>S>Ca.故D正确;
故选A.
点评 本题考查的主要是同周期元素性质的递变规律,运用递变规律解题要判断是同周期还是同主族,才能正确运用规律,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
14.从离子反应的角度来看,浓硫酸、稀硫酸与下列物质反应,本质上不相同的是( )
| A. | Na2SO3 | B. | BaCl2 | C. | CH3COONa | D. | Zn |
15.短周期元素甲,乙,丙,丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数和电子层数相等,则( )
| A. | 原子半径:丙<丁<乙 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 甲,乙,丙的氧化物均为共价化和物 | |
| D. | 乙,丙,丁的最高价氧化物对应的水化物能相互反应 |
12.A、B两种有机物组成的混合物,当混合物质量一定时,无论A、B以何种比例混合,完全燃烧产生CO2的量均相等,符合这一组合的各件有:①同分异构体;②同系物;③具有相同的实验式;④含碳的质量分数相同,其中一定的正确是( )
| A. | ①③④ | B. | ②③ | C. | ①②③ | D. | ①②③④ |
13.下列过程属于化学变化的是( )
| A. | 矿石粉碎 | B. | 海水晒盐 | C. | 生铁冶炼 | D. | 水果榨汁 |
14.将甲乙两种有机物组成的混合物进行分离,已知甲乙的某些特征如下:
则应采取的分离方法是( )
| 物质 | 密度/(g•mL-1) | 沸点 | 水溶性 | 溶解性 |
| 甲 | 0.893 | 78.5℃ | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7℃ | 溶 | 溶于甲 |
| A. | 蒸馏 | B. | 升华 | C. | 分液 | D. | 过滤 |
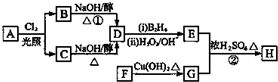
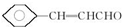 .
. ;
;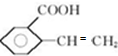 、
、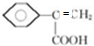 .
.