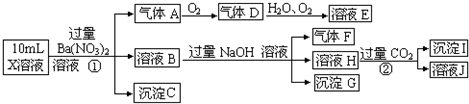
题目内容
试管A中含有10mL 0.6mol/L Na2CO3溶液,试管B中含有10 mL 0.8mol/L HCl溶液,现将试管A逐渐倒入试管B中产生气体的体积与将试管B逐渐倒入试管A中产生气体的体积比为
- A.4∶1
- B.5∶3
- C.3∶1
- D.2∶1
D
此题涉及过量问题,通过计算,Na2CO3=0.006mol,HCl=0.008mol.将A管中Na2CO3滴入B管里的HCl,马上就能产生气体,直到将HCl中的H+消耗干净,离子方程式为CO32-+2H+=H2O+CO2↑通过物质的量关系可以看出CO32-过量,产生气体物质的量为0.004mol.若将B管中液体滴入A管,则先有离子反应H++CO32-=HCO3-,H+过量,生成0.006molHCO3-剩余0.002molH+,继续滴加HCl,又有离子反应H++HCO3-=H2O+CO2↑.相对于0.006molHCO3-,剩余的0.002molH+不足,按剩余H+计算,生成0.002mol气体.所以应该选D.
此题涉及过量问题,通过计算,Na2CO3=0.006mol,HCl=0.008mol.将A管中Na2CO3滴入B管里的HCl,马上就能产生气体,直到将HCl中的H+消耗干净,离子方程式为CO32-+2H+=H2O+CO2↑通过物质的量关系可以看出CO32-过量,产生气体物质的量为0.004mol.若将B管中液体滴入A管,则先有离子反应H++CO32-=HCO3-,H+过量,生成0.006molHCO3-剩余0.002molH+,继续滴加HCl,又有离子反应H++HCO3-=H2O+CO2↑.相对于0.006molHCO3-,剩余的0.002molH+不足,按剩余H+计算,生成0.002mol气体.所以应该选D.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
硫代硫酸钠(Na2S2O3)俗称大苏打,照相业中用作定影剂.Na2S2O3易溶于水,在酸性溶液中与酸反应有单质硫和SO2生成.
(1)现有一瓶Na2S2O3固体,可能含有Na2SO4固体,请设计实验验证,写出实验步骤、预期现象和结论.限选试剂:1mol?L-1 H2SO4、1mol?L-1 HNO3、1mol?L-1 HCl、1mol?L-1 NaOH、0.1mol?L-1 Ba(NO3)2、
0.1mol?L-1 BaCl2、0.01mol?L-1 KMnO4、蒸馏水.
(2)已知重铬酸钠有较强的氧化性,一定条件下可将I-氧化为I2,自身还原为Cr3+,写出该反应的离子方程式: .
依此原理实验室可通过以下方法测定重铬酸钠(Na2Cr2O7?2H2O)样品的纯度:
称取重铬酸钠样品2.5g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol?L-1 H2SO4溶液和足量碘化钾,放于暗处5min,然后加入100mL水,再加入3mL淀粉指示剂,用0.1200mol?L-1 Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-).
①判断达到滴定终点的现象是 .
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中的重铬酸纳的纯度为 (设Na2Cr2O7?2H2O的摩尔质量为298g?mol-1,整个过程中其它杂质不参与反应).
(1)现有一瓶Na2S2O3固体,可能含有Na2SO4固体,请设计实验验证,写出实验步骤、预期现象和结论.限选试剂:1mol?L-1 H2SO4、1mol?L-1 HNO3、1mol?L-1 HCl、1mol?L-1 NaOH、0.1mol?L-1 Ba(NO3)2、
0.1mol?L-1 BaCl2、0.01mol?L-1 KMnO4、蒸馏水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体于试管A中,加蒸馏水溶解 | / |
| 步骤2:向试管A加入 | |
| 步骤3:取步骤2的少量上层清液于试管B中 |
依此原理实验室可通过以下方法测定重铬酸钠(Na2Cr2O7?2H2O)样品的纯度:
称取重铬酸钠样品2.5g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol?L-1 H2SO4溶液和足量碘化钾,放于暗处5min,然后加入100mL水,再加入3mL淀粉指示剂,用0.1200mol?L-1 Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-).
①判断达到滴定终点的现象是
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中的重铬酸纳的纯度为