题目内容
4.0.5mol/L的一元弱酸A和未知浓度的一元强碱B以1:2的体积比混合,所得溶液的c(OH-)=0.1mol/L,用B中和20mL一元弱酸C(该酸溶液c(H+)=0.01mol/L),当恰好完全反应时,用5mL B溶液,求弱酸C的电离度.分析 根据A和B的反应数据计算出弱碱B的物质的量浓度,然后根据弱酸C和强碱B的量计算出一元弱酸C的浓度,最后计算出弱酸C的电离度.
解答 解:0.5mol/L的一元弱酸A和未知浓度的一元强碱B以1:2的体积比混合,所得溶液的c(OH-)=0.1mol/L,
设该一元强碱的浓度为x,则:$\frac{2x-0.5×1}{2+1}$=0.1,解得:x=0.4,该一元强碱溶液的浓度为0.4mol/L,
5mL 0.4mol/L的B溶液中含有B的物质的量为:0.4mol/L×0.005L=0.002mol,
一元弱酸C与一元强碱B按照1:1反应,则反应消耗C的物质的量也是0.002mol,
该一元弱酸C的物质的量浓度为:$\frac{0.002mol}{0.02L}$=0.1mol/L,
所以弱酸C的电离度为:$\frac{0.01mol/L}{0.1mol/L}$×100%=10%,
答:该弱酸C的电离度为10%.
点评 本题考查了酸碱中和反应的计算、电离度的计算,题目难度中等,根据题干数据计算出C的物质的量浓度为解答关键,注意明确电离度的概念及计算方法.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
14.用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+).对该混合溶液的下列判断正确的是( )
| A. | c(OH-)>c(H+) | B. | c(CH3COOH)+c(CH3COO-)=0.2 mol•L-1 | ||
| C. | c(CH3COOH)>c(CH3COO- ) | D. | c(CH3COO- )+c(OH- )=0.2 mol•L-1 |
15.应用所学知识判断,下列说法正确的是( )
| A. | 煤的干馏是物理变化 | |
| B. | CO2、NO2或SO2都会导致酸雨的形成 | |
| C. | NH3液化时放出大量的热,因此,氨常用作制冷剂 | |
| D. | 活性炭、SO2、Na2O2都能使品红溶液褪色,原理相同 |
12.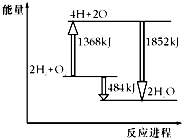 如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法不正确的是( )
如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法不正确的是( )
 如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法不正确的是( )
如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法不正确的是( )| A. | 拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共吸收1368kJ能量 | |
| B. | 由H、O原子形成2molH2O(g),共放出1852kJ能量 | |
| C. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共吸收484kJ能量 | |
| D. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量 |
9.下列溶液一定呈中性的是( )
| A. | 酸与碱恰好完全反应生成正盐的溶液 | |
| B. | pH=7的溶液 | |
| C. | 使石蕊试液呈紫色的溶液 | |
| D. | c(H+)=c(OH-)=10-6mol•L-1的溶液 |
16.一定量的金属Cu完全溶于适量浓硝酸中,收集到混合气体(含NO、N2O4、NO2),将上述混合气体平均分为两份,一份与标准状况下4.48L O2混合后,用水吸收生成HNO3且无气体剩余,另一份恰好能被500 mL 1mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,则其中的NaNO2的物质的量为( )
| A. | 0.1mol | B. | 0.15mol | C. | 0.2mol | D. | 0.4mol |
19.一支试管内充满氯气和甲烷混合物,在强光下反应一段时间,产物最多有几种( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |