题目内容
(2013?江苏)氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
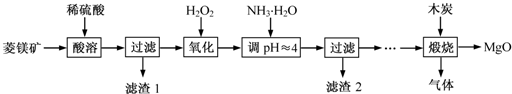
(1)MgCO3与稀硫酸反应的离子方程式为
(2)加入H2O2 氧化时,发生反应的化学方程式为
(3)滤渣2 的成分是
(4)煅烧过程存在以下反应:
2MgSO4+C
2MgO+2SO2↑+CO2↑
MgSO4+C
MgO+SO2↑+CO↑
MgSO4+3C
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.
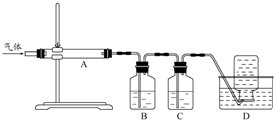
①D中收集的气体可以是
②B中盛放的溶液可以是
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:

(1)MgCO3与稀硫酸反应的离子方程式为
MgCO3+2H+═Mg2++CO2↑+H2O
MgCO3+2H+═Mg2++CO2↑+H2O
.(2)加入H2O2 氧化时,发生反应的化学方程式为
2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O
2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O
.(3)滤渣2 的成分是
Fe(OH)3
Fe(OH)3
(填化学式).(4)煅烧过程存在以下反应:
2MgSO4+C
| ||
MgSO4+C
| ||
MgSO4+3C
| ||
利用如图装置对煅烧产生的气体进行分步吸收或收集.

①D中收集的气体可以是
CO
CO
(填化学式).②B中盛放的溶液可以是
d
d
(填字母).a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:
3S+6OH-
2S2-+SO32-+3H2O
| ||
3S+6OH-
2S2-+SO32-+3H2O
.
| ||
分析:(1)碳酸镁溶于冷水生成硫酸镁水和二氧化碳;
(2)过氧化氢在酸性条件下氧化硫酸亚铁为硫酸铁;
(3)加入氨水调节溶液PH使氢氧化铁全部沉淀;
(4)煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集.
(2)过氧化氢在酸性条件下氧化硫酸亚铁为硫酸铁;
(3)加入氨水调节溶液PH使氢氧化铁全部沉淀;
(4)煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集.
解答:解:(1)MgCO3与稀硫酸反应生成硫酸镁、二氧化碳和水,反应的离子方程式为MgCO3+2H+═Mg2++CO2↑+H2O,
故答案为:MgCO3+2H+═Mg2++CO2↑+H2O;
(2)加入H2O2 氧化时,在酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O,
故答案为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O;
(3)酸溶后过滤得到溶液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液PH使铁离子全部沉淀,过滤后所以得到沉淀为氢氧化铁,
故答案为:Fe(OH)3;
(4)煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集;
①D中收集的气体可以是CO,故答案为:CO;
②B中盛放的溶液可以KMnO4溶液吸收二氧化硫,故答案为:d;
③A中得到的淡黄色固体与热的NaOH溶液反应,依据氧化还原反应原理,产物中元素最高价态为+4,最低价为-2价,反应的离子方程式为:3S+6OH-
2S2-+SO32-+3H2O,
故答案为:3S+6OH-
2S2-+SO32-+3H2O.
故答案为:MgCO3+2H+═Mg2++CO2↑+H2O;
(2)加入H2O2 氧化时,在酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O,
故答案为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O;
(3)酸溶后过滤得到溶液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液PH使铁离子全部沉淀,过滤后所以得到沉淀为氢氧化铁,
故答案为:Fe(OH)3;
(4)煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集;
①D中收集的气体可以是CO,故答案为:CO;
②B中盛放的溶液可以KMnO4溶液吸收二氧化硫,故答案为:d;
③A中得到的淡黄色固体与热的NaOH溶液反应,依据氧化还原反应原理,产物中元素最高价态为+4,最低价为-2价,反应的离子方程式为:3S+6OH-
| ||
故答案为:3S+6OH-
| ||
点评:本题考查了镁铝及其化合物、二氧化硫性质应用,混合物分离方法和实验操作方法,物质性质熟练掌握是解题关键,题目难度中等.

练习册系列答案
相关题目







 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2
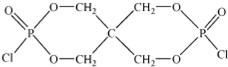
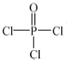 )与季戊四醇(
)与季戊四醇(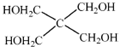 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.