题目内容
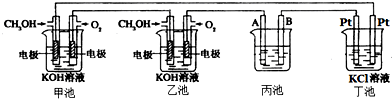
如图是一个电化学过程的示意图.

请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电解池”或“电镀池”).
(2)写出通入CH3OH的电极的电极反应式: .
(3)乙池中反应的化学方程式为 ,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标准状况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液.

请回答下列问题:
(1)图中甲池的名称
(2)写出通入CH3OH的电极的电极反应式:
(3)乙池中反应的化学方程式为
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液.
分析:(1)甲池能自发的进行氧化还原反应,所以属于原电池;
(2)燃料电池中,负极上通入燃料,燃料失电子发生氧化反应;
(3)乙池是电解池,碳作阳极,银作阴极,所以反应是电解硝酸银溶液;根据转移电子守恒计算消耗氧气 等体积,丙池中,阴极上析出金属,根据转移电子计算金属的相对原子质量,从而确定盐.
(2)燃料电池中,负极上通入燃料,燃料失电子发生氧化反应;
(3)乙池是电解池,碳作阳极,银作阴极,所以反应是电解硝酸银溶液;根据转移电子守恒计算消耗氧气 等体积,丙池中,阴极上析出金属,根据转移电子计算金属的相对原子质量,从而确定盐.
解答:解:(1)甲池能自发的进行氧化还原反应,所以属于原电池,故答案为:原电池;
(2)燃料电池中,负极上通入燃料,碱性条件下,甲醇水中和氢氧根离子反应生成碳酸根离子和水,所以电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(3)乙池是电解池,碳作阳极,银作阴极,所以反应是电解硝酸银溶液,电池反应式为:4AgNO3+2H2O
4Ag+O2↑+4HNO3,乙池是电解池,B极上银离子得电子发生还原反应而析出银,根据转移电子相等,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积=
×22.4L/mol=0.28L,
丙池是电解池,阴极上金属离子放电析出金属单质,则金属元素在氢元素之后,D电极连接甲醇电极,所以D是阴极,根据转移电子相等知,当析出一价金属时,其摩尔质量=
=32g/mol,则该元素是硫元素,硫元素是非金属元素,所以错误,当析出的是二价金属,则
=64g/mol,所以该金属是铜,则溶液是硫酸铜溶液,故选B,
故答案为:4AgNO3+2H2O
4Ag+O2↑+4HNO3;0.28;D;B.
(2)燃料电池中,负极上通入燃料,碱性条件下,甲醇水中和氢氧根离子反应生成碳酸根离子和水,所以电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(3)乙池是电解池,碳作阳极,银作阴极,所以反应是电解硝酸银溶液,电池反应式为:4AgNO3+2H2O
| ||
| ||
| 4 |
丙池是电解池,阴极上金属离子放电析出金属单质,则金属元素在氢元素之后,D电极连接甲醇电极,所以D是阴极,根据转移电子相等知,当析出一价金属时,其摩尔质量=
| 1.6g | ||
|
| 1.6g | ||||
|
故答案为:4AgNO3+2H2O
| ||
点评:本题考查了原电池和电解池原理,正确推断原电池中正负极是解本题关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
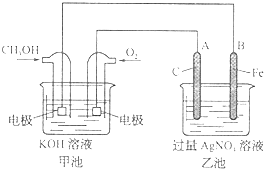 据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH
据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH