题目内容
【题目】工业上用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:

下列说法正确的是( )
A.该反应的△H>0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用高温高压的条件,目的都是提高原料气的转化率
D.t℃时,向1L密闭容器中投入0.1molCO和0.2molH2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
【答案】D
【解析】
A.根据表中数据可知:温度升高,化学平衡常数减小,说明升高温度化学平衡逆向移动,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,逆反应为吸热反应,则该反应的正反应是放热反应,△H<0,A错误;
B.催化剂对正、逆反应速率影响相同,因此不能使化学平衡状态发生移动,因此使用催化剂不能改变CO的转化率,B错误;
C.该反应为放热反应,所以采用高温不能提高反应物的转化率,C错误;
D. t℃时,向1L密闭容器中投入0.1molCO和0.2molH2,平衡时CO转化率为50%,则此时c(CH3OH)=0.05mol/L,△c(CO)=0.05mol/L,△c(H2)=0.1mol/L,平衡时各种气体的物质的量c(CO)=0.1mo/L-0.05mol/L=0.05mol/L,c(H2)=0.1mol/L-0.1mol/L=0.1mol/L,c(CH3OH)=0.05mol/L,所以该温度下平衡常数K=![]() =100,D正确;
=100,D正确;
故合理选项是D。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
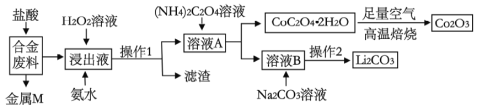
(1)合金废料中加入盐酸浸取,此处盐酸不能换为硝酸,原因是_______________。
(2)操作1用到的玻璃仪器有__________________________。
(3)浸出液中加入H2O2溶液和氨水,应先加入_____________,加入氨水发生反应的离子方程式为____________________。
(4)在空气中焙烧CoC2O4·2H2O的化学方程式是____________________。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
则操作2的具体流程是_______________、_____________、洗涤、干燥。
