题目内容
 现有36%的醋酸(CH3COOH),密度为1g/ml,欲配制0.1mol/L的醋酸250ml,需要取用36%的醋酸________
现有36%的醋酸(CH3COOH),密度为1g/ml,欲配制0.1mol/L的醋酸250ml,需要取用36%的醋酸________
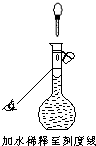
ml.需要使用的实验仪器有烧杯、量筒、玻璃棒、________、________若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度________(填“正确”、“偏大”或“偏小”).
4.2 250mL容量瓶 胶头滴管 偏小
分析:根据c=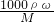 计算醋酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需36%的醋酸的体积.
计算醋酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需36%的醋酸的体积.
根据配制溶液的实验操作过程选择所用仪器.
分析操作对溶质的物质的量或对溶液的体积的影响,根据c=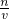 分析判断.
分析判断.
解答:36%的醋酸的物质的量浓度为c=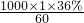 mol/L=6mol/L,根据稀释定律,稀释前后溶质的物质的量不变,来计算36%的醋酸的体积,设36%的醋酸的体积为xmL,所以xmL×6mol/L=250mL×0.1mol/L,解得:x≈4.2.
mol/L=6mol/L,根据稀释定律,稀释前后溶质的物质的量不变,来计算36%的醋酸的体积,设36%的醋酸的体积为xmL,所以xmL×6mol/L=250mL×0.1mol/L,解得:x≈4.2.
所需36%的醋酸的体积为4.2mL.
操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)36%的醋酸,在烧杯中稀释,用玻璃棒搅拌,恢复室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
由提供的仪器可知还需要仪器有:250mL容量瓶、胶头滴管.
由图可知定容时仰视刻度线,导致所配溶液体积增大,所以所配溶液浓度偏小.
故答案为:4.2mL; 250 ml容量瓶; 胶头滴管; 偏小.
点评:本题考查了一定物质的量浓度溶液的配制,注意从c=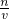 理解配制原理.
理解配制原理.
分析:根据c=
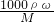 计算醋酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需36%的醋酸的体积.
计算醋酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需36%的醋酸的体积.根据配制溶液的实验操作过程选择所用仪器.
分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
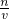 分析判断.
分析判断.解答:36%的醋酸的物质的量浓度为c=
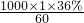 mol/L=6mol/L,根据稀释定律,稀释前后溶质的物质的量不变,来计算36%的醋酸的体积,设36%的醋酸的体积为xmL,所以xmL×6mol/L=250mL×0.1mol/L,解得:x≈4.2.
mol/L=6mol/L,根据稀释定律,稀释前后溶质的物质的量不变,来计算36%的醋酸的体积,设36%的醋酸的体积为xmL,所以xmL×6mol/L=250mL×0.1mol/L,解得:x≈4.2.所需36%的醋酸的体积为4.2mL.
操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)36%的醋酸,在烧杯中稀释,用玻璃棒搅拌,恢复室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
由提供的仪器可知还需要仪器有:250mL容量瓶、胶头滴管.
由图可知定容时仰视刻度线,导致所配溶液体积增大,所以所配溶液浓度偏小.
故答案为:4.2mL; 250 ml容量瓶; 胶头滴管; 偏小.
点评:本题考查了一定物质的量浓度溶液的配制,注意从c=
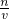 理解配制原理.
理解配制原理. 
练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
(1)某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
a取少量待测液,仔细观察,呈无色;
b向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.
据此可以判断该待测液中一定含有的阳离子是______,一定没有的阳离子是______.还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)______,现象是______.
(2)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.某同学在探究铁的化合物的相互转化时,进行了如下实验.请你参与讨论.
实验操作:向20mL的FeSO4溶液中,滴加浓溴水,振荡.
实验现象:溶液由浅绿色(近乎无色)变成黄色.
a溶液颜色发生改变的原因可能是______(用选项符号表示).
①使溶液呈黄色的微粒是Br2
②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
b为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
| 操作 | 实验现象及结论 | |
| 方案1 | 取少量黄色溶液,加入NaOH | 最终生成红褐色沉淀,说明溴水和FeSO4溶液发生了化学反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 溶液变蓝色,说明未发生化学反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 下层溶液呈橙红色,说明未发生化学反应 |
②方案2的结论明显不合理,可能发生反应的离子方程式为______.
③方案3的结论也不合理,理由是______.
④你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):______.

 Fe2++Ag+,请回答下列问题:
Fe2++Ag+,请回答下列问题: