题目内容
硫元素价态众多,可与卤素、氮等元素化合形成许多复杂化合物,在科学技术和生成中有重要的应用.根据题意完成下列计算:
(1)由硫与限量氯气在50~60°C反应16~20小时,可恰好完全反应,得到两种硫的氯化物A和B.A物质中的含硫量为0.131,B物质中的含氯量为0.816,A的相对分子质量比B大71.计算确定这两种氯化物的分子式分别为______.若上述反应得到的A、B的物质的量比为3:2,则参加反应的S和氯气的物质的量之比为______.
(2)硫的卤化物或卤氧化物都有强水解性,可以作脱水剂.SF4吸收V mL液态水(4℃),完全反应,得到3.2g SO2气体(假设SO2完全逸出)和10%的酸溶液,计算吸收的液态水的体积V为______mL.
(3)S4N4是亮橙色固体,不溶于水和有机溶剂,是一种重要的金属有机化学反应物.一般用S2Cl2、SCl2的惰性溶剂(CS2)氨解制得:6S2Cl2+16NH3→S4N4+S8+12NH4Cl;24SCl2+64NH3→4S4N4+S8+48NH4Cl.S2Cl2、SCl2的混合液体52.86g溶于足量的CS2中,再通入35.84L氨气(标准状况)完全氨解,产生14.080g硫单质.剩余氨气用40g水完全吸收形成氨水(密度为0.923g/mL).
计算:①该混合液体中S2Cl2、SCl2的物质的量之比为______.
②所得氨水的物质的量浓度为______(保留1位小数).
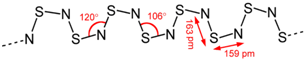
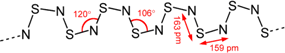
(4)S4N4与Ag在一定条件下反应,失去N2而缩合成(SN)x,(SN)x合成于1910年,过了五十年,才发现它在0.26K的低温下,可转变为超导体(superconductor).(SN)x的结构式如图:
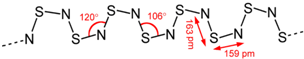
已知1.20×105 mol S4N4与Ag发生缩合,失去了1.20×105 mol N2,生成二百聚物[(SN)200]和三百聚物.测得缩合产物中二百聚物的质量分数为0.50.
计算:①缩合产物中各缩合物的物质的量.
②若Ag的实际使用量为8.64kg,求Ag的循环使用次数.
解:(1)①已知物质组成中各个元素的含量,可以找出该物质的元素个数比,假设取1000gA中,m(Cl)=861g,m(S)=131g,S和Cl个数比:(869÷35.5)÷(131÷32)=6,A的组成为(SCl6)n,同样1000gB中,m(Cl)=816g,m(S)=184g,S和Cl的个数比为:(816÷35.5)÷(184÷32)=4,B的组成为(SCl4)n,由于 A的相对分子质量比B大71,所以A和B中的n都为1,又A、B的物质的量比为3:2,假设有3molA,2molB,根据质量守恒定律,n(S)=3+2=5mol,n(Cl)=6×3+4×2=26mol,n(Cl2)=0.5×n(Cl)=13mol,所以 S和氯气的物质的量之比为 5:13,
故答案为:SCl6、SCl4;5:13;
(2)SF4吸收V mL液态水,n(SO2)=3.2÷64=0.05(mol),反应后溶液质量增加了44×0.05=2.2g,
反应方程式为:SF4+2H2O═SO2↑+4HF,△m
1mol 1mol 4mol 44g
反应后得到的是HF溶液,质量分数为10%,据此列出等式,ω(HF)=0.05×4×20÷(v+2.2)×100%=10%,解得v=37.8,
故答案为:37.8;
(3)①氨气有剩余,说明S2Cl2、SCl2完全反应,有反应方程式 6S2Cl2+16NH3→S4N4+S8+12NH4Cl;24SCl2+64NH3→4S4N4+S8+48NH4Cl,设S2Cl2、SCl2 物质的量分别为xmol、ymol,列出二元一次方程:135x+103y=52.86g,x÷6×32×8+y÷24×8×32=14.080g,解得x=0.3mol,y=0.12mol,0.3:012=5:2,故该混合液体中S2Cl、SCl2的物质的量之比为 5:2,
故答案为:5:2;
②反应消耗的氨气的物质的量为,0.3×16÷6+0.12×64÷24=0.8+0.32=1.12(mol),剩余的氨气的物质的量为,35.84÷22.4-1.12=1.6-1.12=0.48mol,c(NH3)=0.48÷[(40+17×0.48)÷0.923÷1000]≈9.2 (mol/L),所得氨水的物质的量浓度为 9.2 mol/L,故答案为:9.2 mol/L;
(4)①设[(SN)200]、[(SN)300]物质的量分别为xmol、ymol,利用缩合产物中二百聚物的质量分数为0.50,列式为46×200x÷(46×200x+46×300y)=0.5,氮原子守恒列式 200x+300y=1.20×105×4-1.20×105×2,解得x=600mol,y=400ml,即二百聚物为600mol,三百聚物为400mol,
答:二百聚物的物质的量为600mol,三百聚物物质的量为 400mol;
②根据S守恒,生成600二百聚物和400三百聚物,失去了1.20×105 mol N2,同时有2.4×105molS减少,生成了硫化银,生成 2.4×105mol Ag2S,就需要消耗4.8×105molAg,所以Ag的循环使用次数为:4.8×105÷(8.64×1000÷108)=6000(次),答:Ag的循环使用次数为6000次.
分析:(1)已知物质组成中各个元素的含量,找出该物质的元素个数比,例如直接取1000gA、B各自进行计算出S和Cl的个数比,再利用 A的相对分子质量比B大71 得出他们的分子式;A、B的物质的量比为3:2,假设有3molA,2molB,利用原子守恒,得出参加反应的S和氯气的物质的量之比;
(2)根据反应方程式为:SF4+2H2O═SO2↑+4HF,利用“质量差”进行计算;
(3)①由于氨气过量,故S2Cl2、SCl2完全反应,设S2Cl2、SCl2物质的量分别为xmol、ymol,列出二元一次方程求解;
②利用求出的S2Cl2、SCl2 物质的量,得到氨气的剩余量,就可以算出所得氨水的物质的量浓度;
(4)①先设出[(SN)200]、[(SN)300]物质的量分别为xmol、ymol,利用题中缩合产物中二百聚物的质量分数为0.50和氮原子守恒列出二元一次方程进行计算;
②根据S守恒,生成600二百聚物和400三百聚物,失去了1.20×105 mol N2,同时有2.4×105molS生成了硫化银,生成Ag2S就需要4.8×105molAg,算出这些Ag的质量.而现在只有8.64kg,二者相比就可以知道需要银循环的次数.
点评:本题考查了硫元素价态众多,可与卤素、氮等元素化合形成许多复杂化合物的知识,涉及的问题比较多,知识面也比较广,计算量相当大,有分子式的求算,物质的量浓度的计算、物质组成的计算等,难度有点高,注重考查阅读、分析、理解题中信息的能力.
故答案为:SCl6、SCl4;5:13;
(2)SF4吸收V mL液态水,n(SO2)=3.2÷64=0.05(mol),反应后溶液质量增加了44×0.05=2.2g,
反应方程式为:SF4+2H2O═SO2↑+4HF,△m
1mol 1mol 4mol 44g
反应后得到的是HF溶液,质量分数为10%,据此列出等式,ω(HF)=0.05×4×20÷(v+2.2)×100%=10%,解得v=37.8,
故答案为:37.8;
(3)①氨气有剩余,说明S2Cl2、SCl2完全反应,有反应方程式 6S2Cl2+16NH3→S4N4+S8+12NH4Cl;24SCl2+64NH3→4S4N4+S8+48NH4Cl,设S2Cl2、SCl2 物质的量分别为xmol、ymol,列出二元一次方程:135x+103y=52.86g,x÷6×32×8+y÷24×8×32=14.080g,解得x=0.3mol,y=0.12mol,0.3:012=5:2,故该混合液体中S2Cl、SCl2的物质的量之比为 5:2,
故答案为:5:2;
②反应消耗的氨气的物质的量为,0.3×16÷6+0.12×64÷24=0.8+0.32=1.12(mol),剩余的氨气的物质的量为,35.84÷22.4-1.12=1.6-1.12=0.48mol,c(NH3)=0.48÷[(40+17×0.48)÷0.923÷1000]≈9.2 (mol/L),所得氨水的物质的量浓度为 9.2 mol/L,故答案为:9.2 mol/L;
(4)①设[(SN)200]、[(SN)300]物质的量分别为xmol、ymol,利用缩合产物中二百聚物的质量分数为0.50,列式为46×200x÷(46×200x+46×300y)=0.5,氮原子守恒列式 200x+300y=1.20×105×4-1.20×105×2,解得x=600mol,y=400ml,即二百聚物为600mol,三百聚物为400mol,
答:二百聚物的物质的量为600mol,三百聚物物质的量为 400mol;
②根据S守恒,生成600二百聚物和400三百聚物,失去了1.20×105 mol N2,同时有2.4×105molS减少,生成了硫化银,生成 2.4×105mol Ag2S,就需要消耗4.8×105molAg,所以Ag的循环使用次数为:4.8×105÷(8.64×1000÷108)=6000(次),答:Ag的循环使用次数为6000次.
分析:(1)已知物质组成中各个元素的含量,找出该物质的元素个数比,例如直接取1000gA、B各自进行计算出S和Cl的个数比,再利用 A的相对分子质量比B大71 得出他们的分子式;A、B的物质的量比为3:2,假设有3molA,2molB,利用原子守恒,得出参加反应的S和氯气的物质的量之比;
(2)根据反应方程式为:SF4+2H2O═SO2↑+4HF,利用“质量差”进行计算;
(3)①由于氨气过量,故S2Cl2、SCl2完全反应,设S2Cl2、SCl2物质的量分别为xmol、ymol,列出二元一次方程求解;
②利用求出的S2Cl2、SCl2 物质的量,得到氨气的剩余量,就可以算出所得氨水的物质的量浓度;
(4)①先设出[(SN)200]、[(SN)300]物质的量分别为xmol、ymol,利用题中缩合产物中二百聚物的质量分数为0.50和氮原子守恒列出二元一次方程进行计算;
②根据S守恒,生成600二百聚物和400三百聚物,失去了1.20×105 mol N2,同时有2.4×105molS生成了硫化银,生成Ag2S就需要4.8×105molAg,算出这些Ag的质量.而现在只有8.64kg,二者相比就可以知道需要银循环的次数.
点评:本题考查了硫元素价态众多,可与卤素、氮等元素化合形成许多复杂化合物的知识,涉及的问题比较多,知识面也比较广,计算量相当大,有分子式的求算,物质的量浓度的计算、物质组成的计算等,难度有点高,注重考查阅读、分析、理解题中信息的能力.

练习册系列答案
相关题目