题目内容
11.下列说法正确的是( )| A. | 用冰醋酸、蒸馏水和容量瓶等可以配制pH=1的醋酸溶液 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 反应SiO2(s)+3C(s)═SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
分析 A、醋酸为弱酸,难以配制pH=1的溶液;
B、加水稀释促进一水合氨电离,加入氯化铵固体抑制一水合氨电离;
C、依据反应自发想的判断依据是△H-T△S<0,结合反应特征分析;
D、温度升高Ca(OH)2的溶解度变小.
解答 解:A、醋酸为弱酸,难以配制pH=1的溶液,可配制0.1mol/L的溶液,故A错误;
B、加水稀释促进一水合氨电离,一水合氨电离增大程度小于溶液体积增大程度,所以溶液中c(OH-)减小,加入氯化铵固体抑制一水合氨电离,一水合氨电离向逆反应方向移动,导致溶液中c(OH-)减小,c(H+)增大,故B正确;
C、依据反应自发想的判断依据是△H-T△S<0,结合反应特征分析,反应SiO2(s)+3C(s)═SiC(s)+2CO(g)室温下不能自发进行,△H-T△S>0,反应的熵变△S>0,则△H>0,故C错误;
D、温度升高Ca(OH)2的溶解度变小,故升高温度,Ca(OH)2的溶解速率增大,但其Ksp减小,故D正确;
故选BD.
点评 本题考查了反应自发进行的判断依据、水的电离平衡影响因素分析应用等,掌握基础是关键,D选项氢氧化钙随温度升高溶解度减小,题目较简单.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
2.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 标准状况下,22.4 L SO3中含有氧原子数目为3.0NA | |
| B. | 常温常压下,12.0 gNaHSO4中含有离子总数为0.3NA | |
| C. | 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA | |
| D. | 在1 L 0.1 mol•L-1碳酸钠溶液中,阴离子总数大于0.1NA |
19. 工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:
N2(g)+O2(g)═2NO(g)△H=+a kJ•mol-1
N2(g)+3H2(g)═2NH3(g)△H=-b kJ•mol-1
2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1
若有34g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为(1.5c-a-b)kJ.
(2)合成NH3达到平衡后,某时刻改变下列条件A,在达到新平衡的过程中正反应速率始终增大.
A.升温 B.加压 C.增大c(N2) D.降低c(NH3)
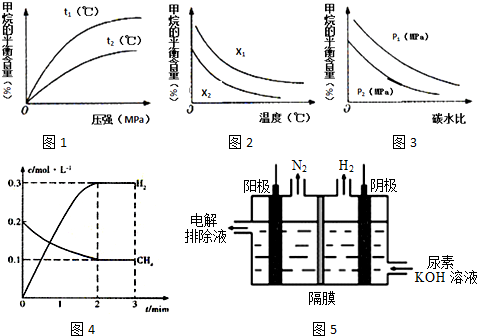
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如如图1所示:(图中T表示温度,n表示起始时H2物质的量)
①图象中T2和T1的关系是:T2<T1(填“>”、“<”、“=”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是c(填字母).
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为0.02 mol•L-1.
(4)一定温度下,将2mol N2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如表:
表中a、b、80%三者的大小关系为80%<a=b或80%<a<b.(填“>”、“=”、“<”、“无法比较”)
(5)向绝热、恒容的密闭容器中通入H2、N2使其在一定条件下合成NH3,请在图2中画出平衡常数K随时间的变化曲线.
 工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:
N2(g)+O2(g)═2NO(g)△H=+a kJ•mol-1
N2(g)+3H2(g)═2NH3(g)△H=-b kJ•mol-1
2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1
若有34g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为(1.5c-a-b)kJ.
(2)合成NH3达到平衡后,某时刻改变下列条件A,在达到新平衡的过程中正反应速率始终增大.
A.升温 B.加压 C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如如图1所示:(图中T表示温度,n表示起始时H2物质的量)
①图象中T2和T1的关系是:T2<T1(填“>”、“<”、“=”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是c(填字母).
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为0.02 mol•L-1.
(4)一定温度下,将2mol N2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如表:
 | 1小时 | 2 小时 | 3小时 | 4小时 |
| T3 | 30% | 50% | 80% | 80% |
| T4 | 35% | 60% | a | b |
(5)向绝热、恒容的密闭容器中通入H2、N2使其在一定条件下合成NH3,请在图2中画出平衡常数K随时间的变化曲线.
6.工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ•mol-1、-285.8kJ•mol-1和-283.0kJ•mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ•mol-1.
(2)在一定条件下,向体积固定为2L的密闭容器中充入0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图4所示.
3min时改变条件,反应进行到t1min时,体系中各物质的物质的量如下表所示:
则3~t1min之间,平衡向正(填“正”或“逆”)反应方向移动,3min时改变的条件是升高温度.
(3)已知温度、压强和碳水比[$\frac{n(C{H}_{4})}{n({H}_{2}O)}$]对该反应的影响如图所示.
①图l中,两条曲线所示温度的关系:t1<t2(填“>”、“<”或“=”,下同).
②图2中,两条曲线所示碳水比的关系:x1>x2.
③图3中,两条曲线所示压强的关系:p1>p2.
(4)氢气也可利用电解尿素制备.电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图5图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.

(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ•mol-1.
(2)在一定条件下,向体积固定为2L的密闭容器中充入0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图4所示.
3min时改变条件,反应进行到t1min时,体系中各物质的物质的量如下表所示:
| t/min | n(CH4)/mol | n(H2O)/mol | n(CO)/mol | n(H2)/mol |
| t1 | 0.18 | 0.38 | 0.22 | 0.66 |
(3)已知温度、压强和碳水比[$\frac{n(C{H}_{4})}{n({H}_{2}O)}$]对该反应的影响如图所示.
①图l中,两条曲线所示温度的关系:t1<t2(填“>”、“<”或“=”,下同).
②图2中,两条曲线所示碳水比的关系:x1>x2.
③图3中,两条曲线所示压强的关系:p1>p2.
(4)氢气也可利用电解尿素制备.电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图5图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
16.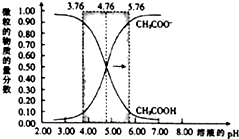 25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )
25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )
 25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )
25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )| A. | 当溶液pH=3.76时,c(CH3COOH)>c(CH3COO-) | |
| B. | 当溶液pH=4.76时,c(CH3COO-)=c(CH3COOH)>c(OH-)=c(H+) | |
| C. | 当溶液pH=5.76时,CH3COO-的物质的量分数约为0.91 | |
| D. | 当溶液3<pH<7时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=10(pH-pKa) |
3.原子序数依次递增的四种短周期元素X、Y、Z、M,其中X和Z、Y和M分别同主族,Z和M同周期,X、Y、Z均不同周期,M的核电荷数是Y的2倍.下列说法正确的是( )
| A. | 简单阳离子的氧化性:Z>X | |
| B. | 气态氢化物的稳定性:M>Y | |
| C. | 简单离子半径由大到小的顺序是:M>Y>Z | |
| D. | 在X2M与Z2M的溶液中,水的电离程度,前者大于后者 |
20.能证明乙酸是弱酸的实验事实是( )
| A. | CH3COOH溶液与Zn反应放出H2 | |
| B. | 0.1 mol/L CH3COONa溶液的pH大于7 | |
| C. | CH3COOH溶液与Na2CO3反应生成CO2 | |
| D. | 0.1 mol/L CH3COOH溶液可使紫色石蕊变红 |
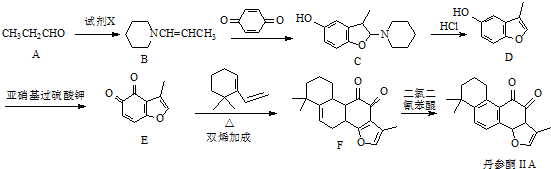
 .
. .
. 的合成路线流程图(无机试剂可任选).
的合成路线流程图(无机试剂可任选).