题目内容
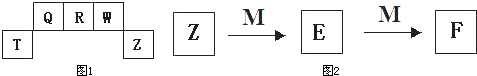
(1)Q 的气态氢化物的分子式为
(2)Z 元素比R 元素的非金属性强.能证明这一结论的事实是
①相同条件下,Z 单质在水中的溶解性强于R 单质
②Z单质与氢气化合比R 单质与氢气化合容易
③Z 的氢化物比R 的氢化物稳定
(3)向T、Z元素形成的化合物的溶液中逐滴加入NaOH 溶液,先产生白色沉淀;继续滴加NaOH溶液,直至沉淀溶解.写出沉淀溶解的反应离子方程式:
(4)QW 和RW都是汽车尾气中含有的大气污染物,它们在汽车排气管的“催化转换器”中反应生成可参与大气生态循环的无毒气体,化学方程式为
(5)M是一种常见的金属单质,与元素Z的单质有如图2所示转化关系,则E转化为F的反应的离子方程式是
把一定量的M 放入E溶液中,完全反应后,所得溶液中E、F的物质的量相等,则已反应的E与未反应的E的物质的量之比为
由转化关系可知,M为变价金属,则为Fe,所以E为FeCl3,F为FeCl2,结合反应方程式来解答.
(1)Q的气态氢化物为甲烷,其分子式为CH4,空间结构为正四面体,故答案为:CH4;正四面体;
(2)①相同条件下,Z单质在水中的溶解性强于R单质,不能利用溶解性比较非金属性,故不选;
②Z单质与氢气化合比R单质与氢气化合容易,则Z活泼,Z元素比R元素的非金属性强,故选;
③Z的氢化物比R的氢化物稳定,则Z元素比R元素的非金属性强,故选;
故答案为:②③;
(3)氯化铝与NaOH反应生成氢盐化铝沉淀,继续加NaOH沉淀溶解的离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)由信息可知,CO和NO反应生成氮气和二氧化碳,其化学反应为2CO+2NO
| ||
| ||
(5)由转化关系可知,M为变价金属,则为Fe,所以E为FeCl3,F为FeCl2,E转化为F的反应的离子方程式是2Fe3++Fe=3Fe2+,溶液中E、F的物质的量相等,设生成F为3mol,由反应方程式可知反应的E为2mol,剩余的E为mol,所以已反应的E与未反应的E的物质的量之比为2:3,故答案为:2Fe3++Fe=3Fe2+;2:3.

几种短周期元素的原子半径及主要化合价如下表所示:下列叙述正确的是( )
|
(8分)
已知短周期元素T、 Q、R、W在元素周期表中的位置如右表所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
|
| Q | R |
|
| T |
|
| W |
(1)T的原子结构示意图为 。
(2)元素的非金属性为(原子的得电子能力):W Q(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)已知原子序数比R多1的元素,其一种氢化物能分解为它的另一种氢化物,此分解反应的化学方是 。
(5)已知R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式的是 。
(8分)
 已知短周期元素T、 Q、R、W在元素周期表中的位置如表所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
已知短周期元素T、 Q、R、W在元素周期表中的位置如表所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
| | Q | R | |
| T | | | W |
 (1)T的原子结构示意图为 。
(1)T的原子结构示意图为 。 (2)元素的非金属性为(原子的得电子能力):W Q(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):W Q(填“强于”或“弱于”)。 (3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。 (4)已知原子序数比R多1的元素,其一种氢化物能分解为它的另一种氢化物,此分解反应的化学方是 。
(4)已知原子序数比R多1的元素,其一种氢化物能分解为它的另一种氢化物,此分解反应的化学方是 。 (5)已知R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式的是 。
(5)已知R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式的是 。 (8分)
 已知短周期元素T、 Q、R、W在元素周期表中的位置如右表所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
已知短周期元素T、 Q、R、W在元素周期表中的位置如右表所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
|
|
Q |
R |
|
|
T |
|
|
W |
(1)T的原子结构示意图为 。
 (2)元素的非金属性为(原子的得电子能力):W Q(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):W Q(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
 (4)已知原子序数比R多1的元素,其一种氢化物能分解为它的另一种氢化物,此分解反应的化学方是
。
(4)已知原子序数比R多1的元素,其一种氢化物能分解为它的另一种氢化物,此分解反应的化学方是
。
(5)已知R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式的是 。