题目内容
(综合应用)用含FeS280%的硫铁矿生产硫酸,已知该矿石的燃烧率为95%,SO2的转化率为90%,SO3的吸收率为98%。若生产500 t98%的硫酸,需矿石的质量和标准状况下空气的体积(假设空气中氧 的体积分数为20%)是多少?
答案:
解析:
解析:
| 点拨解答:此题涉及到多步连续反应的计算,若采用相当量关系式的方法,则把各步反应的转化率当成原料的有效成分含量。特别注意的是:氧气参与了两个反应,在找氧气和H2SO4的关系式时,不可漏掉任何一步反应所消耗的氧气。
设需要矿石的质量为m,氧气物质的量为n。由反应的化学方程式可得: FeS2 ~ 2H2SO4 120 196 m·80%·95%·90%·98% 500t·98% 解之得:m=447.5t 15O2 ~ 8H2SO4 15mo1 784g n 500t·98%·106g 解之得:n=9.38X106mol 所需空气的体积为 V=9.38×l06mol×22.4 L·mol-1÷20%=1.05Xl09L。
|

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 MnS2O6的△H
MnS2O6的△H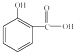 (1)食品和药品关系人的生存和健康.
(1)食品和药品关系人的生存和健康.