题目内容
某研究小组模拟工业上以黄铁矿为原料制备硫酸的第一步反应:
4FeS2+11O2![]() 2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应).
2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应).

实验步骤:称取研细的样品4.000 g放入上图b装置中,然后在空气中进行煅烧.为测定未反应高锰酸钾的量(假设其溶液体积保持不变),实验完成后取出d中溶液10 mL置于锥形瓶里,用0.1000 mol/L草酸(H2C2O4)标准溶液进行滴定.(已知:5SO2+2KMnO4+2H2O![]() K2SO4+2MnSO4+2H2SO4)
K2SO4+2MnSO4+2H2SO4)

请回答下列问题:
(1)称量样品质量能否用托盘天平________(填“能”或“不能”);
(2)装置a的作用是________;
(3)上述反应结束后,仍需通一段时间的空气,其目的是________;
(4)滴定时,发生反应的离子方程式为________,已知滴定管初读数为0.10 mL,末读数如上图所示,消耗草酸溶液的体积为________mL;
(5)该样品中FeS2的纯度为________;
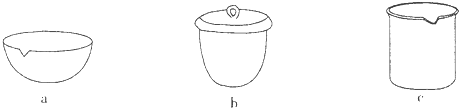
(6)若用下图装置替代上述实验装置d,同样可以达到实验目的的是________.(填编号)

答案:
解析:
解析:
|
(1)不能(1分) (2)干燥空气(或干燥或除去水蒸气均可),观察气体流速(2分,各1分.) (3)促进装置中的二氧化硫气体全部吸收(2分,意思对即可给分) (4)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O(2分,没配平扣1分,气体符号不写不扣分,写化学方程式不给分) 15.00(2分) (5)90%(3分,写成0.9或90.00%也可以,有效数字不考虑) (6)②(2分,多选不给分) |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。


 2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。



 (2)上述反应结束后,仍需通一段时间的空气,其目的是_______________________________
(2)上述反应结束后,仍需通一段时间的空气,其目的是_______________________________