题目内容
A、B、C、D、E为原子序数依次增大的短周期元素.已知A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3,回答:
(1)写出下列元素符号:A________、C________、D________;
(2)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式________;A、E两元素最高价氧化物的水化物相互反应的化学方程式________;
(3)比较C、D最高价氧化物对应水化物的酸性________.
答案:
解析:
解析:
|
[解析]A、B、E三元素最高价氧化物对应的水化物为酸或碱,两两皆能反应,必有一种是两性物质Al(OH)3,另两种为强酸、强碱,碱是NaOH,又A、B、E三原子最外层电子数之和为11,且原子序数依次增大,可推出E原子最外层7个电子,短周期元素中只有Cl符合要求,两两反应的三种物质是NaOH、Al(OH)3、HClO4,C、D原子序数小于17,大于13,推出为Si和P,非金属性Si<P,因此酸性H4SiO4<H3PO4. |

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
【化学--选修3:物质结构与性质】
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)G位于 族 区,价电子排布式为 .
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形.
(3)画出C原子的电子排布图 .
(4)已知BA5为离子化合物,写出其电子式 .
(5)DE3中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
(6)用电子式表示F元素与E元素形成化合物的形成过程 .
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
形.
(3)画出C原子的电子排布图
(4)已知BA5为离子化合物,写出其电子式
(5)DE3中心原子的杂化方式为
(6)用电子式表示F元素与E元素形成化合物的形成过程
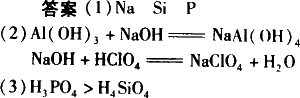
 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:

