题目内容
人体内产生的活性氧能加速人体衰老,被称为“生命杀手”.化学家尝试用Na2SeO3清除人体内活性氧,Na2SeO3在体内的作用是( )
| A、氧化剂 |
| B、还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:活性氧具有强氧化性,用Na2SeO3清除人体内活性氧,说明Na2SeO3具有还原性,据此分析解答.
解答:
解:活性氧具有强氧化性,强氧化性物质能氧化还原性物质,用Na2SeO3清除人体内活性氧,说明Na2SeO3具有还原性,还原剂具有还原性,所以Na2SeO3在体内作还原剂,故选B.
点评:本题考查了氧化还原反应,明确物质的性质即可解答,知道常见物质的性质,题目难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
下列实验操作中错误的是( )
| A、使用试管夹,应从试管底部往上套,夹在试管中上部 |
| B、进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C、蒸馏时,加热一段时间后发现未加碎瓷片,立刻拨开橡皮塞并投入碎瓷片 |
| D、用稀盐酸清洗做焰色反应的铂丝 |
“物质的量”是联系宏观世界和微观世界的桥梁.下列说法正确的是( )
| A、“摩尔”是“物质的量”的单位 |
| B、1 mol O2的质量是32 g/mol |
| C、任何气体的“气体摩尔体积”均为22.4 L/mol |
| D、10 mL 2 mol/L H2SO4溶液中取出的5 mL溶液,其浓度为1 mol/L |
用价层电子对互斥理论预测CO32-和BF3的立体结构分别是( )
| A、平面三角形;三角锥形 |
| B、三角锥形;平面三角形 |
| C、三角锥形;三角锥形 |
| D、平面三角形;平面三角形 |
 如图是已经合成的最著名硫-氮化合物分子结构.下列说法正确是( )
如图是已经合成的最著名硫-氮化合物分子结构.下列说法正确是( )| A、该物质的分子式为SN |
| B、该物质中的N原子最外层都达到8电子稳定结构 |
| C、该物质的分子中既有极性键又有非极性键 |
| D、该物质与化合物S2N2互为同素异形体 |
以下四种有机物的分子式皆为C4H10O:
①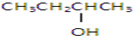
②CH3CH2CH2CH2OH
③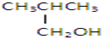
④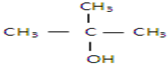
其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
①
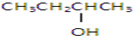
②CH3CH2CH2CH2OH
③
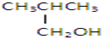
④
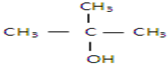
其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
| A、①② | B、只有② |
| C、②和③ | D、③和④ |
在室温下,pH相同、体积相同的氨水和氢氧化钠溶液,采取下列措施后,有关叙述正确的是( )
| A、温度下降20℃,两溶液的pH均不变 |
| B、各加水稀释10倍,两溶液的pH仍相等 |
| C、分别加入适量的氯化铵晶体,两溶液的pH均减小 |
| D、各用相同物质的量浓度的盐酸中和,所消耗盐酸的体积相等 |
合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g)△H=-92.4kJ?mol-1.现将1molN2(g)、3molH2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分为?,下列说法中正确的是
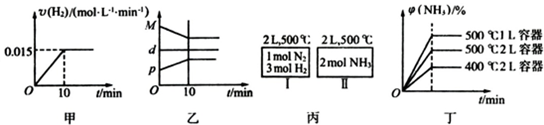 ( )
( )
 ( )
( )| A、若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 |
| B、反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 |
| C、如图丙所示,容器I和II达到平衡时所需要的时间可能不同 |
| D、若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
以下5种有机物的分子式都是C4H10O:
① ②
② ③
③ ④
④ ⑤CH3CH2OCH2CH3.
⑤CH3CH2OCH2CH3.
其中能被氧化为含相同碳原子数的醛的是( )
①
 ②
② ③
③ ④
④ ⑤CH3CH2OCH2CH3.
⑤CH3CH2OCH2CH3.其中能被氧化为含相同碳原子数的醛的是( )
| A、①② | B、只有② |
| C、②③ | D、③④⑤ |