题目内容
恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g)→Na2S(s)+4H2O(g).下列说法正确的是( )
分析:A、化学平衡常数=生成物浓度的系数次幂之积与反应物系数次幂之积的比(注意是平衡时的浓度,且不适用于固体);
B、反应前后气体的体积不变,所以反应体系中的压强始终不变;
C、改变起始充入H2的浓度相当于改变体系的压强,根据压强对该反应是否有影响判断;
D、根据固体质量的变化量计算反应的硫酸钠,根据转化率公式计算其转化率.
B、反应前后气体的体积不变,所以反应体系中的压强始终不变;
C、改变起始充入H2的浓度相当于改变体系的压强,根据压强对该反应是否有影响判断;
D、根据固体质量的变化量计算反应的硫酸钠,根据转化率公式计算其转化率.
解答:解:A、该反应的平衡常数表达式K=
,故A错误;
B、该反应是一个反应前后气体体积不变的化学反应,所以无论该反应是否达到平衡状态,压强始终不变,故B错误;
C、改变起始充入H2的浓度相当于改变体系的压强,增大或减小压强,只改变化学反应速率不影响平衡的移动,所以达平衡时H2的转化率不变,故C正确;
D、设反应了硫酸钠xg
Na2SO4(s)+4H2(g)=Na2S(s)+4H2O(g) 固体质量减少.
142g 64g
xg 2.84g-2.264g
x=1.278
Na2SO4的转化率=
×100%=45%,故D正确;
故选CD.
| [c(H2O)]4 |
| [c(H2)]4 |
B、该反应是一个反应前后气体体积不变的化学反应,所以无论该反应是否达到平衡状态,压强始终不变,故B错误;
C、改变起始充入H2的浓度相当于改变体系的压强,增大或减小压强,只改变化学反应速率不影响平衡的移动,所以达平衡时H2的转化率不变,故C正确;
D、设反应了硫酸钠xg
Na2SO4(s)+4H2(g)=Na2S(s)+4H2O(g) 固体质量减少.
142g 64g
xg 2.84g-2.264g
x=1.278
Na2SO4的转化率=
| 1.278g |
| 2.84g |
故选CD.
点评:本题考查了化学平衡的影响因素,易错选项是C,把氢气浓度的变化转变为压强的变化来分析解答C选项.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
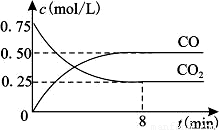
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
(1)下列措施中能使平衡时K增大的是___________(填序号);
A.升高温度??? B.增大压强C.充入一定量COD.降低温度
(2)8分钟内,CO的平均反应速率v(CO)=___________mol/(L·min);
(3)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
容器 | 甲 | 乙 |
反应物投入量 | 3molFe、2molCO2 | 4molFeO、3molCO |
CO的浓度(mol/L) | C1 | C2 |
CO2的体积分数 |
|
|
体系压强(Pa) | P1 | P2 |
气态反应物的转化率 |
|
|
①下列说法正确的是___________;
A.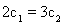 B.
B.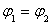 C.P1<P2D.
C.P1<P2D.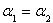
②求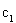 =___________、
=___________、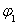 =___________、
=___________、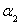 =___________。
=___________。
恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g) 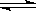 Na2S(s)+4H2O(g)。下列说法正确的是
Na2S(s)+4H2O(g)。下列说法正确的是
| A.该反应的平衡常数表达式K=c(H2O)/c(H2) |
| B.若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态 |
| C.若Na2SO4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 |
| D.若初始时投入2.84gNa2SO4与一定量H2,反应达平衡时容器内固体共有2.264g,则Na2SO4的转化率为45% |