题目内容
为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
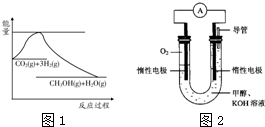
(1)图1表示该反应过程中能量变化,则该反应为______反应(填“吸热”或“放热”),判断依据是______;
(2)某实验小组依据甲醇燃烧的反应原理,设计如图2所示的电池装置.
①该电池正极的电极反应式为:______;
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为:______;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______;
(4)为了消除污染,在一定条件下,向含有甲醇的废水中加入一定量的稀硝酸,会有N2等物质生成.若参加反应的氧化剂和还原剂的物质的量之比为6:5,写出该反应的化学方程式______;在此反应过程中若消耗32g 甲醇,将转移______mol 电子.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
(1)图1表示该反应过程中能量变化,则该反应为______反应(填“吸热”或“放热”),判断依据是______;
(2)某实验小组依据甲醇燃烧的反应原理,设计如图2所示的电池装置.
①该电池正极的电极反应式为:______;
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为:______;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______;
(4)为了消除污染,在一定条件下,向含有甲醇的废水中加入一定量的稀硝酸,会有N2等物质生成.若参加反应的氧化剂和还原剂的物质的量之比为6:5,写出该反应的化学方程式______;在此反应过程中若消耗32g 甲醇,将转移______mol 电子.

(1)由图1可知,反应物的总能量高于生成物的总能量,故该反应为放热反应,故答案为:放热;反应物的总能量高于生成物的总能量;
(2)①原电池正极发生还原反应,氧气在正极放电,碱性条件下生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②该原电池实质为甲醇燃烧生成二氧化碳与水,二氧化碳在与氢氧化钾反应生成碳酸钾与水,该原电池总的反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,
故答案为:2CH3OH+3O2+4KOH=2K2CO3+6H2O;
(3)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
由盖斯定律,①-②+③×4得2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l),故△H=-1275.6kJ∕mol-(-566.0kJ/mol)+(-44.0kJ/mol)×4=-885.6 kJ∕mol,
故CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol;
(4)反应中硝酸为氧化剂,甲醇为还原剂,根据电子转移守恒,令C元素在氧化产物的化合价为a,则:
6×5=5×[a-(-2)],解得a=4,故氧化产物为CO2,反应方程式为:5CH3OH+6HNO3=3N2↑+5CO2↑+13H2O,
甲醇的物质的量为
=1mol,反应C元素化合价由-2价升高为+4,故转移电子的物质的量为1mol×[4-(-2)]=6mol,
故答案为:5CH3OH+6HNO3=3N2↑+5CO2↑+13H2O;6;
(2)①原电池正极发生还原反应,氧气在正极放电,碱性条件下生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②该原电池实质为甲醇燃烧生成二氧化碳与水,二氧化碳在与氢氧化钾反应生成碳酸钾与水,该原电池总的反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,
故答案为:2CH3OH+3O2+4KOH=2K2CO3+6H2O;
(3)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
由盖斯定律,①-②+③×4得2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l),故△H=-1275.6kJ∕mol-(-566.0kJ/mol)+(-44.0kJ/mol)×4=-885.6 kJ∕mol,
故CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol;
(4)反应中硝酸为氧化剂,甲醇为还原剂,根据电子转移守恒,令C元素在氧化产物的化合价为a,则:
6×5=5×[a-(-2)],解得a=4,故氧化产物为CO2,反应方程式为:5CH3OH+6HNO3=3N2↑+5CO2↑+13H2O,
甲醇的物质的量为
| 32g |
| 32g/mol |
故答案为:5CH3OH+6HNO3=3N2↑+5CO2↑+13H2O;6;

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
 (2012?通州区一模)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:
(2012?通州区一模)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应: CO2(g)+3H2(g)
CO2(g)+3H2(g)


 该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:
该物质在现代工业合成中大有用途,请回答下列有关该物质的问题: