题目内容
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Ni、Si、P等元素)制备,回答下面问题:
(1)钴元素在元素周期表中的位置____。![]() 与硫元素位于同一主族,其价层电子排布式是___。
与硫元素位于同一主族,其价层电子排布式是___。
(2)MnSO4中阴离子的空间构型是____中心原子的杂化类型______。
(3)比较H2S ______H2Se热稳定性:(填“>”“<”)判断依据是______;比较沸点:N2H4 _____P2H4 (填“>”“<”),判断依据是______。
(4) FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(FeCl3)2存在,画出其结构并标出配位键__________。
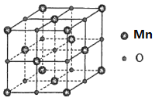
(5)MnO具有NaCl型结构(如图),其中阳离子采用面心立方最密堆积方式,设其晶胞参数为apm,则r(Mn2+)为______pm晶胞密度是_____g/cm3(用含a的表达式表示)
【答案】第四周期第VIII族 7s27p4 正四面体 sp3 > S的非金属性强于Se > N2H4分子间形成氢键 
![]() a
a ![]()
【解析】
(1)钴元素为27号元素,位于第四周期第VIII族;![]() 质子数为116,则其原子核外有116个电子,则其电子层结构为2,8,18,32,32,18,6,位于第七周期,与S元素位于同一主族,则其价电子排布为7s27p4;
质子数为116,则其原子核外有116个电子,则其电子层结构为2,8,18,32,32,18,6,位于第七周期,与S元素位于同一主族,则其价电子排布为7s27p4;
(2)硫酸锰中阴离子为SO![]() ,中心原子价层电子对数为
,中心原子价层电子对数为![]() =4,不含孤电子对,所以空间构型为正四面体形,中心原子采取sp3杂化;
=4,不含孤电子对,所以空间构型为正四面体形,中心原子采取sp3杂化;
(3)S和Se位于同一主族,同主族元素自上而下非金属性减弱,所以非金属性:S>Se,则简单氢化物的稳定性H2S>H2Se;N2H4能形成分子间氢键,P2H4分子间不能形成氢键,所以沸点:N2H4>P2H4;
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(FeCl3)2存在,与AlCl3相似,氯原子提供孤电子对,Fe原子提供空轨道形成配位键,其结构式为 (“→”表示出其中的配位键);
(“→”表示出其中的配位键);
(5)阳离子采用面心立方最密堆积方式,即Mn2+为面心立方最密堆积,则位于面对角线上的Mn2+相切,所以有4r(Mn2+)=![]() a pm,所以r(Mn2+)=
a pm,所以r(Mn2+)=![]() a pm;根据均摊法,晶胞中Mn2+的个数为
a pm;根据均摊法,晶胞中Mn2+的个数为![]() =4,晶体化学式为MnO,则O2-的个数也为4,所以晶胞的质量m=
=4,晶体化学式为MnO,则O2-的个数也为4,所以晶胞的质量m=![]() ,晶胞棱长为a pm,则晶胞的体积V=a3pm3=(a×10-10)3cm3,所以晶体的密度为
,晶胞棱长为a pm,则晶胞的体积V=a3pm3=(a×10-10)3cm3,所以晶体的密度为 =
=![]() g/cm3。
g/cm3。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案【题目】观察下表模型并结合有关信息,判断下列说法中不正确的是( )
B12结构单元 | SF6分子 | S8分子 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点1873 K | — | 易溶于CS2 | — |
A.单质硼属于原子晶体,每个B12结构单元中含有30个B—B键和20个正三角形
B.SF6是由极性键构成的非极性分子
C.固态硫S8属于原子晶体
D.HCN的结构式为H—C≡N
【题目】一定温度下,在4个体积均为 1.0 L的恒容密闭容器中反应2SO2(g)+O2 (g)![]() 2SO3(g) 达到平衡。
2SO3(g) 达到平衡。
下列说法正确的是
容器 | 温度/K | 物质的起始浓度/moI/L | 物质的平衡浓度moI/L | O2或SO3平衡转化率 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | |||
Ⅰ | 723 | 0.2 | 0.2 | 0 | 0.04 | α1 |
Ⅱ | 723 | 0 | 0.1 | 0.2 | α2 | |
Ⅲ | 723 | 0.4 | 0.4 | 0 | α3 | |
IV | 823 | 0 | 0.1 | 0.2 | α4 | |
A. 达到平衡时, α1+α2=1
B. 达到平衡时,容器中的压强:PⅠ>PIV
C. 达到平衡时,逆反应速率容器IV中比容器Ⅰ中的大
D. 达平衡后,再向容器Ⅰ中充入0.16 mol SO2、0.04 mol SO3,则此时反应向逆反应方向进行