题目内容
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下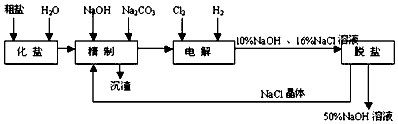
(1)粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的化学方程式是 , .
(2)如果粗盐中SO42﹣含量较高,必须添加钡式剂除去SO42﹣ , 该钡试剂可以是
A.Ba(OH)2
B.Ba(NO3)2
C.BaCl2
(3)电解过程中所发生反应的化学方程式为 , 与电源正极相连的电极附近产生的气体是 , 检验该气体可使用试纸,现象是试纸变为色.
(4)氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下: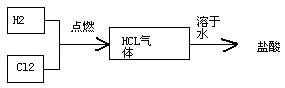
其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是 . 合成盐酸厂要求合成气中的HCl的含量要大于97%,试用最简便的方法进行分析是否含量大于97% .
(5)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为 .
(6)某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显色,往B试管中通入干燥的氯化氢气体,试纸显色.最后向C试管中加入物质(填化学式),他之所以加入这种物质的理由是 .
【答案】
(1)CaCl2+Na2CO3=CaCO3↓+2NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(2)A,C
(3)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,Cl2,湿润的碘化钾淀粉,蓝
2NaOH+H2↑+Cl2↑,Cl2,湿润的碘化钾淀粉,蓝
(4)先通H2,再通Cl2;通H2点燃后再通Cl2,用100 mL刻度瓶收集满HCl气体,置于水中,水升至97 mL以上即认为符合要求
(5)Cl2+2NaOH→NaCl+NaClO+H2O
(6)红,蓝,H2O,证明单独的氯化氢气体或水均不能使蓝色石蕊试纸变色
【解析】解:(1)工业食盐中含有较多的Ca2+、Mg2+杂质,可以用试剂NaOH、Na2CO3除去反应为氯化钙和碳酸钠反应生成碳酸钙沉淀,氯化镁和氢氧化钠反应生成氢氧化镁沉淀,所以化学方程式为CaCl2+Na2CO3→CaCO3↓+2NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
所以答案是:CaCl2+Na2CO3=CaCO3↓+2NaCl; MgCl2+2NaOH→Mg(OH)2↓+2NaCl;
(2)除去粗盐中的SO42﹣,可加Ba2+形成BaSO4白色沉淀,由于不能引进其他阴离子,所以钡试剂只能用BaCl2或Ba(OH)2,故AC正确,
所以答案是:AC;
(3)在电解过程中,与电源负极相连的电极为阴极,电解池中阴极氢离子得到电子生成氢气,电极反应式为:2H++2e﹣═H2↑;阳极氯离子失去电子生成氯气,2Cl﹣﹣2e﹣=Cl2,电解过程中反应的化学方程式为:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,氯气能够使淀粉碘化钾溶液变蓝,可用湿润的淀粉碘化钾试纸检验氯气,现象是试纸变为蓝色,
2NaOH+H2↑+Cl2↑,氯气能够使淀粉碘化钾溶液变蓝,可用湿润的淀粉碘化钾试纸检验氯气,现象是试纸变为蓝色,
所以答案是:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑; Cl2;湿润的碘化钾淀粉; 蓝;
2NaOH+H2↑+Cl2↑; Cl2;湿润的碘化钾淀粉; 蓝;
(4)氯气有毒,为保证氯气完全反应,应该先通入氢气,再通入氯气,通入氯气前应先点燃氢气,氯化氢易溶于水,所以验证的方法是:取一个有刻度的玻璃瓶,收集一瓶合成气,倒放在水槽中,观察水面上升的高度,进行粗略估计,用100 mL刻度瓶收集满HCl气体,置于水中,水升至97 mL以上即认为符合要求,
所以答案是:先通H2,再通Cl2;通H2点燃后再通Cl2;用100 mL刻度瓶收集满HCl气体,置于水中,水升至97 mL以上即认为符合要求;
(5)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
所以答案是:Cl2+2NaOH=NaCl+NaClO+H2O;
(6)盐酸是一种酸,盐酸溶液中的氢离子能使蓝色石蕊试液变成红色,氯化氢既不属于酸也不属于碱,不能能使蓝色石蕊试纸变色,仍为蓝色;盐酸能使蓝色石蕊试纸变红,盐酸是氯化氢气体的水溶液,氯化氢气体和水能不能使蓝色石蕊试纸变红呢?通过B试管中实验已经排除了单独的氯化氢气体不能使蓝色石蕊试纸变色,还需要进一步排除单独的水也不能使使蓝色石蕊试纸变色,要利用控制变量法向C试管中单独加入水进行试验,水的化学式为H2O.
所以答案是:红;蓝;H2O;证明单独的氯化氢气体或水均不能使蓝色石蕊试纸变色.



