题目内容
【题目】碳元素的单质存在多种同素异形体,下图依次是C60、石墨和金刚石的结构图。

(1)①C60属于__________晶体,石墨属于_________晶体。
②C60晶体、石墨和金刚石的熔点由高到低的顺序是_________。
(2)C60是一系列碳原子簇合物(即富勒烯)的一个典型代表,它的应用十分广泛,涉及光学、信息学、药物学、催化、储氢、超导等。
①目前,化学家已经找到十余种富勒烯家庭成员,如C28、C32、C50、C60……,它们的分子结构都是由正五边形和正六边形构成的封闭的凸多面体,多面体遵循欧拉定律:顶点数+面数-棱边数=2。则C80晶体结构中正五边形有_______个,C80晶体共有_____条棱。
②下列物质不属于富勒烯家庭的有_________(填序号)
A. C18 B. C44 C. C72 D. C83
(3)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性,其晶胞结构如图所示(其中·为碳原子,O为硅原子),每个碳原子周围与其距离最近的硅原子有____个;设晶胞边长为a nm,密度为bg·cm-3,则阿伏加德罗常数可表示为_______。(用含a、b的式子表示)
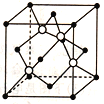
【答案】 分子 混合(过渡) 石墨>金刚石>C60 12 120 AD 4 ![]()
【解析】试题分析:(1)①根据晶体的构成微粒判断晶体类型;②原子晶体的熔点>离子晶体>分子晶体;(2)①顶点数等于碳原子数;每个碳原子被3个棱共用,所以棱数=顶点数×![]() ,根据欧拉定律:顶点数+面数-棱边数=2,可计算总面数;②根据是否符合遵循欧拉定律判断;(3)根据晶胞结构示意图判断碳原子周围与其距离最近的硅原子数;晶胞中Si为8×
,根据欧拉定律:顶点数+面数-棱边数=2,可计算总面数;②根据是否符合遵循欧拉定律判断;(3)根据晶胞结构示意图判断碳原子周围与其距离最近的硅原子数;晶胞中Si为8×![]() +6×
+6×![]() =4,根据
=4,根据 ,可计算得NA;
,可计算得NA;
解析:(1)①构成C60的微粒是分子,C60是分子晶体,石墨是混合晶体;②C60是分子晶体熔点最低,石墨的层内共价键键长比金刚石的的键长短,作用力更大,破坏化学键需要更大能量,石墨比金刚石熔点更高,所以熔点石墨>金刚石>C60;(2)①C80顶点数等于80;每个碳原子被3个棱共用,所以棱数=80×![]() =120 ,根据欧拉定律:顶点数+面数-棱边数=2,总面数=2+120-80=42,设正五边形有x个,正六边形有y个;
=120 ,根据欧拉定律:顶点数+面数-棱边数=2,总面数=2+120-80=42,设正五边形有x个,正六边形有y个; ![]() ,x=12,正五边形有12个;
,x=12,正五边形有12个;
②C18顶点数是18,棱数是27,总面数=2+27-18=11,设正五边形有x个,正六边形有y个; ![]() 无解 ,故A不可能有;C44顶点数是44,棱数是66,总面数=2+66-44=24,设正五边形有x个,正六边形有y个;
无解 ,故A不可能有;C44顶点数是44,棱数是66,总面数=2+66-44=24,设正五边形有x个,正六边形有y个; ![]() 有解,故B有可能;C72顶点数是72,棱数是108,总面数=2+108-72=38,设正五边形有x个,正六边形有y个;
有解,故B有可能;C72顶点数是72,棱数是108,总面数=2+108-72=38,设正五边形有x个,正六边形有y个; ![]() 有解 ,故C可能有;C83顶点数是83,棱数是83×
有解 ,故C可能有;C83顶点数是83,棱数是83×![]() 不是整数,故D不可能有;(3)根据晶胞结构示意图碳原子周围与其距离最近的硅原子数是4;
不是整数,故D不可能有;(3)根据晶胞结构示意图碳原子周围与其距离最近的硅原子数是4;
晶胞中Si为8×![]() +6×
+6×![]() =4,根据
=4,根据 ,整理得NA=
,整理得NA=![]() ;
;

 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案


