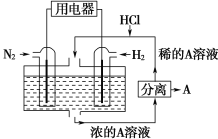
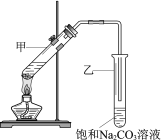
题目内容
【题目】某磁黄铁矿的主要成分是![]() 为
为![]() 价
价![]() ,既含有
,既含有![]() 又含有
又含有![]() 。将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应
。将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应![]() 注:矿石中其他成分不与盐酸反应
注:矿石中其他成分不与盐酸反应![]() ,生成硫单质2.4g、FeCl20.425mol和一定量
,生成硫单质2.4g、FeCl20.425mol和一定量![]() 气体,且溶液中无
气体,且溶液中无![]() 。则下列说法不正确的是
。则下列说法不正确的是 ![]()
![]()
A.该磁黄铁矿中![]() 的
的![]()
B.该磁黄铁矿![]() 中,
中,![]() 与
与![]() 的物质的量之比为
的物质的量之比为![]()
C.生成的![]() 气体在标准状况下的体积为9.52L
气体在标准状况下的体积为9.52L
D.100mL的盐酸中HCl物质的量浓度为8.5mol/L
【答案】B
【解析】
![]() ,根据转移电子守恒得
,根据转移电子守恒得![]() ,则
,则![]() ,所以
,所以![]() 与
与![]() 的物质的量之比
的物质的量之比![]() :
:![]() :6,根据氢原子、氯原子守恒得
:6,根据氢原子、氯原子守恒得![]() ;
;
A.![]() 中
中![]() ,
,![]() ,所以
,所以![]() :
:![]() :
:![]() ,所以
,所以![]() ,故A正确;
,故A正确;
B.由以上分析可知,![]() 与
与![]() 的物质的量之比
的物质的量之比![]() :
:![]() :6,故B错误;
:6,故B错误;
C.根据氢原子、氯原子守恒得![]() ,
,![]() ,故C正确;
,故C正确;
D.盐酸恰好反应生成![]()
![]() ,根据氯原子守恒得
,根据氯原子守恒得![]() ,故D正确;
,故D正确;
故答案为B。

【题目】滴定是一种重要的定量实验方法:
I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:

(1)滴定盐酸的曲线是图__________(填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________(电离度=![]() ×100%)。
×100%)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”);若图中E点pH=8,则c(Na+)-c(CH3COO-)的精确值为__________mol/L。
Ⅱ. 现使用酸碱中和滴定法测定市售白醋中醋酸的浓度
(1)实验步骤:
①量取10.00 mL市售白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀得待测白醋溶液。
②用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
③读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。
④滴定。当___________________时,停止滴定,并记录NaOH溶液的最终读数。
⑤重复②、③、④步骤3次。
数据记录如下:
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(2)数据处理:
根据实验数据计算,可得市售白醋中醋酸的浓度为_________ mol/L
(3)误差在本实验的滴定过程中,下列操作会使实验结果偏大的是_________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前平视读数,滴定后俯视读数
【题目】已知A、B、C、D、E、F、G为前四周期中的常见元素,且原子序数依次增大,A的原子半径最小;B的基态原子L层电子数是K层电子数的2倍;C与B同周期且基态原子最外层电子排布式为nsmnpm+2;D、E、F、G是位于同一周期的金属元素,元素D的焰色反应要透过蓝色钴玻璃才能观察到紫色;且D、G的原子序数相差10;E元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,且E、F的电子数相差1。
请回答下列问题:
(1)基态E原子的价电子排布式为___。
(2)与BC分子互为等电子体的离子为___ (填化学式,任写一种)。
(3)在液态非极性分子B6A6中,B原子采取的杂化方式为___。
(4)元素C的简单氢化物的沸点比同主族的简单氢化物都高的原因是___。
(5)F可形成化学式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4。向另一种配合物的溶液中加入BaCl2溶液时,无明显现象。若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为___。
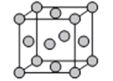
(6)金属D、G晶体的晶胞结构如图所示。
①金属G的晶胞中,测得晶胞中G原子的半径为apm,则G晶体的密度为___g/cm3(列出表达式即可,NA为阿伏伽德罗常数的值),D、G两种晶胞中金属的配位数之比为___。
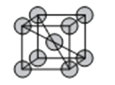
②金属G、锌两种元素的笫一电离能、第二电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 |
G | 746 | 1958 |
锌 | 906 | 1733 |
G的第二电离能(I2)大于锌的第二电离能(I2),其主要原因是___。