题目内容
【题目】若反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0在恒温、恒容的密闭体系中进行,下列示意图正确且能说明该反应在进行到t1时刻达到平衡状态的是( )
2CO2(g)+N2(g) ΔH<0在恒温、恒容的密闭体系中进行,下列示意图正确且能说明该反应在进行到t1时刻达到平衡状态的是( )
A.  B.
B. 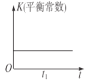 C.
C.  D.
D. 
【答案】D
【解析】
根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
A.t1时正反应速率最大,但仍然在变化,说明没有达到平衡状态,故A项错误;
B.温度不变,化学平衡常数不变,与反应是否达到平衡无关,故B项错误;
C.t1时二氧化碳和一氧化碳的物质的量相等,但还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故C项错误;
D.t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,反应达到了平衡状态,故D正确。
综上,本题选D。

【题目】在1 L容器中用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)![]() 2H2O(g)+2Cl2(g) ΔH<0,一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
2H2O(g)+2Cl2(g) ΔH<0,一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
t/min | 0 | 2 | 4 | 6 |
n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
A. 0~2 min的反应速率小于4~6 min的反应速率
B. 2~6 min用Cl2表示的反应速率为0.9 mol/(L·min)
C. 增大压强可以提高HCl转化率
D. 平衡常数K(200 ℃)<K(400 ℃)
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H3=________kJ/mol(用含a、b的代数式表示)。
Ⅱ.一定条件下,CO2和CO可以互相转化。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8 mol CO2(g)、16 mol H2(g) |
乙 | w mol CO2(g)、x mol H2(g)、y mol CO(g)、z mol H2O(g) |
甲容器15 min后达到平衡,此时CO2的转化率为75%。则0~15 min内平均反应速率v(H2)=______,此条件下该反应的平衡常数K=______。
欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是:y______z(填“>”、“<”或“=”),且y=______(用含x、w的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:
C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:

则△H_____0(填“>”、“<”或“=”),压强p1、p2、p3从大到小的顺序是________。
(3)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为________。
CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为________。


