题目内容
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是________;
(3)SO![]() 的立体构型是________,其中S原子的杂化轨道类型是________;
的立体构型是________,其中S原子的杂化轨道类型是________;
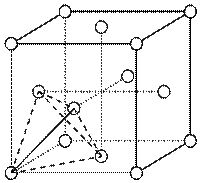
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为________;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为________.
答案:
解析:
解析:
|
(1)Cu+2H2SO4(浓) (2)白色无水硫酸铜可与水结合生成蓝色的CuSO4·5H2O,显示水合铜离子特征蓝色; (3)正四面体,sp3; (4)6s1;3∶1;金属键; (5)H8AuCu3 |

练习册系列答案
相关题目