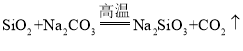题目内容
【题目】下列说法错误的是( )
A.已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1;②2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1;③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141kJ·mol-1;则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=2ΔH1-ΔH2+ΔH3
B.有机物M经过太阳光光照可转化成N,ΔH=+88.6kJ·mol-1。则N比M更稳定
C.已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0kJ·mol-1
2NH3(g) ΔH=-92.0kJ·mol-1
D.已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1则a<726.5
O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1则a<726.5
【答案】B
【解析】
A.已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1;②2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1;③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141kJ·mol-1,则根据盖斯定律可知①×2-②+③即得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=2ΔH1-ΔH2+ΔH3,A正确;
B.有机物M经过太阳光光照可转化成N,ΔH=+88.6kJ·mol-1,这说明M的总能量低于N的总能量,则M比N更稳定,B错误;
C.已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)与3molH2(g)反应生成NH3(g)的反应热为(946+436×3-3×2×391)kJ/mol=-92kJ/mol,所以热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0kJ·mol-1,C正确;
2NH3(g) ΔH=-92.0kJ·mol-1,C正确;
D.已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,则CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-726.5kJ·mol-1,CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) ΔH=-726.5kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1,由于氢气继续燃烧放热,则a<726.5,D正确。
O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1,由于氢气继续燃烧放热,则a<726.5,D正确。
答案选B。

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案