题目内容
6.大力发展电动汽车,可以有效控制空气污染.目前机动车常使用的电池有铅蓄电池、锂电池等.Ⅰ.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4?充电放电2PbSO4+2H2O,锂硫电池充放电的总反应为:2Li+S$?_{放电}^{充电}$Li2S.
(1)放电时,铅蓄电池的负极反应式为Pb-2e-+SO42-=PbSO4.
(2)锂硫电池工作时,电子经外电路流向正极(填“正极”或“负极”).
(3)当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的4.5倍.
Ⅱ.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:
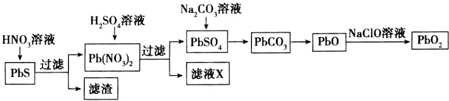
(1)油画所用的白色颜料PbSO4置于空气中,遇H2S气体变成黑色PbS,从而使油画的色彩变暗,用H2O2清洗,可使油画“复原”.
①H2O2的作用是氧化剂.
②已知硫化铅溶于水时存在溶解平衡:PbS(s)?Pb2+(aq)+S2-(aq),试分析PbS(s)能溶于稀HNO3的原因硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解.
(2)滤液X是一种可循环使用的物质,其溶质主要是HNO3(填化学式),若X中残留的SO42-过多,循环使用时可能出现的问题是浸出时部分铅离子生成硫酸铅随浸出渣排出,降低硫酸铅的产率.
(3)①PbO与次氯酸钠溶液反应可制得PbO2,写出该反应的离子方程式PbO+ClO-=PbO2+Cl-.
②以石墨为电极,电解Pb(NO3)2溶液也可以制得PbO2,则阳极的电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+;电解时为提高Pb元素的利用率,常在Pb(NO3)2溶液中加入适量Cu(NO3)2,理由是加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子在阴极放电,增大铅离子的利用率.
分析 (1)放电时,铅蓄电池的负极发生氧化反应,而铅离子与溶液中的硫酸根离子生成难溶的硫酸铅,电极反应式为:Pb-2e-+SO42-=PbSO4;
(2)原电池工作时电子由负极流向正极;
(3)铅蓄电池中铅是负极,207g铅消耗时转移 2mol e-,故钠硫电池的理论放电量是铅蓄电池的$\frac{207}{46}$=4.5 倍;
Ⅱ.(1)①过氧化氢将黑色PbS氧化成白色的硫酸铅,所以过氧化氢是氧化剂;
②已知硫化铅溶于水时存在溶解平衡:PbS(s)?Pb2+(aq)+S2-(aq),电离产生的硫离子具有还原性,而硝酸具有强氧化性,发生氧化还原反应,导致硫离子的浓度减少,固平衡正向移动;
(2)硝酸铅与硫酸发生复分解反应生成难溶硫酸铅,和硝酸;残留的SO42-过多,会与溶液中的铅离子结合成难溶的硫酸铅,导致铅的流失,减少了二氧化铅的产量;
(3)①PbO和次氯酸钠反应生成二氧化铅和氯化钠;②电解时,阳极上铅离子失电子和水反应生成二氧化铅;加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子放电,从而大大提高铅离子的利用率.
解答 解:(1)放电时,铅蓄电池的负极发生氧化反应,而铅离子与溶液中的硫酸根离子生成难溶的硫酸铅,电极反应式为:Pb-2e-+SO42-=PbSO4,故答案为:Pb-2e-+SO42-=PbSO4;
(2)原电池工作时电子由负极流向正极,故答案为:正极;
(3)铅蓄电池中铅是负极,207g铅消耗时转移 2mol e-,故钠硫电池的理论放电量是铅蓄电池的:$\frac{207}{46}$=4.5 倍,故答案为:4.5;
Ⅱ.(1)①过氧化氢将黑色PbS氧化成白色的硫酸铅,所以过氧化氢是氧化剂,故答案为:氧化剂;
②已知硫化铅溶于水时存在溶解平衡:PbS(s)?Pb2+(aq)+S2-(aq),电离产生的硫离子具有还原性,而硝酸具有强氧化性,发生氧化还原反应,导致硫离子的浓度减少,固平衡正向移动,故答案为:硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解;
(2)硝酸铅与硫酸发生复分解反应生成难溶硫酸铅,和硝酸;残留的SO42-过多,会与溶液中的铅离子结合成难溶的硫酸铅,导致铅的流失,减少了二氧化铅的产量,故答案为:HNO3;浸出时部分铅离子生成硫酸铅随浸出渣排出,降低硫酸铅的产率;
(3)①PbO和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为PbO+ClO-=PbO2+Cl-;②电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+;加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子放电,从而大大提高铅离子的利用率,
故答案为:PbO+ClO-=PbO2+Cl-;Pb2++2H2O-2e-=PbO2↓+4H+,加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子在阴极放电,增大铅离子的利用率.
点评 本题考查电化学的相关知识,涉及物质的量的有关计算、离子反应、电解原理等知识点,注意(3)中阳极、阴极电极反应式的书写,为易错点.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 硫酸与氯化钠反应 | B. | 硝酸银溶液中滴加稀氨水 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 铁粉加入硝酸中 |
| B | C |
| D |
| A. | 简单离子的半径大小关系:B>C>E | |
| B. | D、E两种元素形成的化合物,可能含有离子键和共价键 | |
| C. | A、B、C三种元素形成的化合物,晶体类型一定相同 | |
| D. | B、D分别和C形成的化合物,都有可能使溴水或品红溶液褪色 |
| A. | 氯酸钾和二氧化锰的混合物制取氧气 | |
| B. | 石灰石和盐酸制取二氧化碳 | |
| C. | 浓盐酸和二氧化锰制取氯气 | |
| D. | 铜与稀硝酸反应制取一氧化氮 |
| A. | 标况下11.2L乙烷分子中所含分子数为0.5NA | |
| B. | 1.8g的NH4+中含有的电子数为0.1NA | |
| C. | 20克氖气所含原子数为0.5NA | |
| D. | 常温常压下,48g O3和O2的混合气体中,含有氧原子数为3NA |
| A. | 在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42-=BaSO4↓ | |
| B. | 钠与水的反应Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氯气通入氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O | |
| D. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
| 选项 | 用途 | 解释 |
| A | 硅胶可作袋装食品的干燥剂 | 硅胶多孔,吸收空气中氧气的能力强 |
| B | CuSO4可作游泳池的消毒剂 | 铜盐能使构成病毒的蛋白质变性 |
| C | 浸有高锰酸钾溶液的硅藻土可作某些水果的保鲜剂 | 高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| D | Na2O2可作呼吸面具中的供氧剂 | Na2O2能吸收CO2同时放出O2 |
| A. | A | B. | B | C. | C | D. | D |