题目内容
下列叙述中正确的是( )
分析:A、依据强电解质完全电离,弱电解质存在电离平衡进行分析;
B、依据弱电解质存在电离平衡,结合pH与氢离子浓度的关系分析判断;
C、根据溶液中存在的离子积常数,对比分析两溶液中水电离的离子浓度计算;
D、依据溶液中电荷守恒的实质是阴阳离子的电荷守恒,与溶液中的离子种类有关.
B、依据弱电解质存在电离平衡,结合pH与氢离子浓度的关系分析判断;
C、根据溶液中存在的离子积常数,对比分析两溶液中水电离的离子浓度计算;
D、依据溶液中电荷守恒的实质是阴阳离子的电荷守恒,与溶液中的离子种类有关.
解答:解:A、体积相同、浓度均为0.1mol/L的NaOH溶液、氨水都是一元碱,氢氧化钠是强碱,氨水是弱碱存在电离平衡,稀释相同倍数时,氨水溶液中的氢氧根离子浓度大,分别稀释m倍、n倍,溶液的pH都变成9时,氨水需要稀释的倍数比氢氧化钠溶液要大,即 m<n,故A正确;
B、甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,说明甲溶液中氢离子浓度大,醋酸溶质浓度甲大于乙溶液,与相同量氢氧化钠反应时,醋酸和氢氧化钠溶质按1:1反应,所以需要的溶液的体积应是V(乙)>10V(甲),故B正确;
C、25℃时溶液中存在离子积Kw=[H+][OH-]=10-14,pH=9的NaOH溶液中水电离出的[H+]=10-9mol/L,pH=9的NaAc溶液中[H+][OH-]水=10-14,所以水电离出的[H+]水=[OH-]水=
=10-5mol/L,故C错误;
D、碳酸钠溶液中存在的阴阳离子与碳酸氢钠溶液相同,所以溶液中的电荷守恒都是c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误;
故选AB.
B、甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,说明甲溶液中氢离子浓度大,醋酸溶质浓度甲大于乙溶液,与相同量氢氧化钠反应时,醋酸和氢氧化钠溶质按1:1反应,所以需要的溶液的体积应是V(乙)>10V(甲),故B正确;
C、25℃时溶液中存在离子积Kw=[H+][OH-]=10-14,pH=9的NaOH溶液中水电离出的[H+]=10-9mol/L,pH=9的NaAc溶液中[H+][OH-]水=10-14,所以水电离出的[H+]水=[OH-]水=
| 10-14 |
| 10-9 |
D、碳酸钠溶液中存在的阴阳离子与碳酸氢钠溶液相同,所以溶液中的电荷守恒都是c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误;
故选AB.
点评:本题考查了弱电解质的电离平衡的计算与判断,溶液离子积的应用,溶液的稀释与pH的计算,溶液中电荷守恒的应用.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
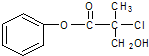 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


