题目内容
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生 的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ/mol(反应I)
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H2=-175.6kJmol-l(反应II)
CaS(s)+4CO2(g) △H2=-175.6kJmol-l(反应II)
请冋答下列问题:
(1)反应I能够自发进行的条件是____________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应II的Kp="___________" (用表达式表示)。
(3)假设某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是______________。

(4)通过监测反应体系中气体浓度的变化判断反应I和II是否同时发生,理由是___________。
(5)图I为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有__________。
A.向该反应体系中投入石灰石 B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数 D.提高反应体系的温度
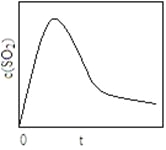
(6)恒温恒容条件下,假设反应I和II同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)
随时间t变化的总趋势图。

【答案】(1)较高温度下 (2)P4(CO2)/P4(CO)(3)C (4)有无二氧化硫可知反应I是否发生,如c(CO2)=c(SO2),则反应II未发生,如c(CO2)>c(SO2),则反应同时发生 (5)ABC
(6)
【解析】试题分析:(1)反应Ⅰ吸热,则△H>0,由方程式可知△S>0,反应能自发进行,应满足△G=△H-T△S<0,因此应在较高温度下进行,即选择高温。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则根据反应的化学方程式可知,反应Ⅱ的Kp=P4(CO2)/P4(CO)。
(3)反应Ⅰ为吸热反应,产物的能量高于反应物,反应Ⅱ为放热反应,产物的能量低于反应物,则A、D错误;由方程式可知反应Ⅱ气体较多,则活化能较大,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则B错误、C正确,答案选C。
(4)反应Ⅰ生成SO2,反应Ⅱ只生成CO2,如同时发生,则两种气体的浓度比变化,据此可以确定是否发生两个反应。即如c(CO2)=c(SO2),则反应II未发生,如c(CO2)>c(SO2),则反应同时发生。
(5)A、向该反应体系中投入石灰石,产生CO2,使反应I逆向进行,可使更多的二氧化硫转化为硫酸钙,减少二氧化硫的排放,A正确;B、由反应Ⅰ可知生成二氧化硫的反应为吸热反应,则低温下不利于生成二氧化硫,图中可以看出温度最低时的CaS的含量最高,则应在合适的温度区间内控制较低的反应温度,B正确;C、由图像可知,提高CO的初始体积百分数,可以增大CaS的质量分数,减少二氧化硫的排放,C正确;D、提高反应体系的温度,不利于二氧化硫的减少,D错误,答案选ABC。
(6)反应Ⅰ和Ⅱ同时发生,且反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),故SO2增加的快,反应达到平衡的快;随着反应II的进行,CO2的浓度不断增大,使反应I平衡逆向移动,SO2浓度又逐渐降低。则图像应为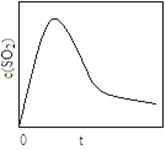 。
。

