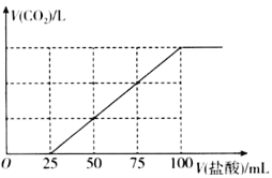
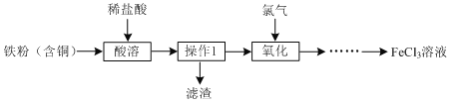
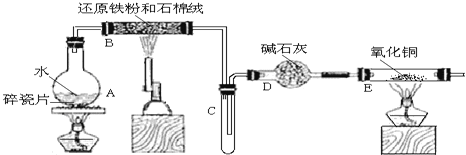
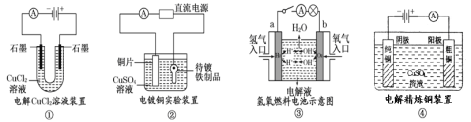
题目内容
【题目】2019年度诺贝尔化学奖授予美国得州大学奥斯汀分校JohnB.Goodenough教授等人,以表彰其在锂离子电池的发展方面作出的突出贡献。研究表明:Li-Cu4O(PO4)2电池的正极的活性物质Cu4O(PO4)2制备的原理为:2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O。请回答:
(1)在周期表中,与Li的化学性质最相似的邻族元素在周期表中位置是__。
(2)Cu4O(PO4)2中Cu2+基态电子排布式为__,PO43-的空间构型是___。
(3)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则[Cu(CN)4]2-中含有的σ键与π键的数目比为__。
(4)(NH4)2SO4中电负性最大的元素是__。所含化学键的类型有__。
(5)冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
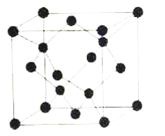
①每个冰晶胞平均占有__个水分子,冰的熔点远低于金刚石熔点的原因是__。
②在气相中NH3易与H2O通过氢键以水合物形式存在。试写出水合物NH3·H2O的结构式:__。
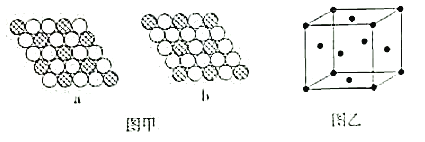
(6)如图甲所示为二维平面晶体示意图。其中表示CuCl2的晶体结构的是___(填“a”或“b”)。金属铜的晶胞如图乙所示,铜原子的配位数是__。若此晶胞立方体的边长为apm,金属铜的密度为ρg·cm-3,则阿伏加德罗常数可表示为___mol-1(用含a、ρ的代数式表示)。
【答案】第三周期ⅡA族 [Ar]3d9 正四面体 1:1 O 离子键、配位键、共价键(极性键) 8 熔化时克服的分子间作用力不同,冰是氢键和分子间作用力,金刚石是共价键 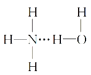 或
或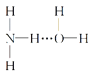 a 12
a 12 ![]()
【解析】
根据对角线规则确定相似元素在周期表中的位置;根据核外电子排布规律确定粒子的电子排布式;根据VSEPR模型确定粒子的空间构型;元素的电负性,同周期自左至右,元素的电负性逐渐增大,同一主族,从上到下,元素电负性逐渐减小,据此规律进行分析;根据均摊法确定晶体中粒子的个数;据此分析。
(1)根据对角线相似规律,周期表中位于对角线位置的元素性质相似可知,在周期表中,与Li的化学性质最相似的邻族元素为Mg元素,Mg元素在周期表中位置是第三周期ⅡA族,答案为:第三周期ⅡA族;
(2)Cu元素的原子序数为29,其基态电子排布式为:[Ar]3d104s1,失去2个电子后,Cu2+基态电子排布式为:[Ar]3d9;PO43-中其中心原子P原子的孤电子对数=![]() ,价电子对数为4,则PO43-的空间构型是正四面体型。答案为:[Ar]3d9;正四面体型;
,价电子对数为4,则PO43-的空间构型是正四面体型。答案为:[Ar]3d9;正四面体型;
(3)1个[Cu(CN)4]2-中含有4个配位键,CN-含有碳氮三键,其中1个是σ键,另外2个是π键,则配合物[Cu(CN)4]2-中含有的σ键与π键的数目比为8:8=1:1;答案为:1:1;
(4)根据同周期自左至右,元素的电负性逐渐增大,同一主族,从上到下,元素电负性逐渐减小,可知(NH4)2SO4中电负性最大的元素是O;(NH4)2SO4中存在N-H极性共价键和S-O极性共价键,铵根离子与硫酸根离子之间存在离子键,![]() 中N原子提供电子对,其中1个H原子提供空轨道,故
中N原子提供电子对,其中1个H原子提供空轨道,故![]() 中还存在配位键,由此可知,(NH4)2SO4中存在离子键、配位键、共价键(极性键);答案为:O;离子键、配位键、共价键(极性键);
中还存在配位键,由此可知,(NH4)2SO4中存在离子键、配位键、共价键(极性键);答案为:O;离子键、配位键、共价键(极性键);
(5)①由冰晶胞结构可知,每个冰晶胞中含有的水分子数目为![]() ,故每个冰晶胞中平均占有8个水分子;水分子中含有共价键、氢键和分子间作用力,金刚石中的化学键为共价键,二者融化时,破坏的作用力不同,金刚石融化需要破坏共价键,而冰融化需要破坏氢键和分子间作用力,故冰的熔点远低于金刚石熔点。答案为:8;熔化时克服的分子间作用力不同,冰是氢键和分子间作用力,金刚石是共价键;
,故每个冰晶胞中平均占有8个水分子;水分子中含有共价键、氢键和分子间作用力,金刚石中的化学键为共价键,二者融化时,破坏的作用力不同,金刚石融化需要破坏共价键,而冰融化需要破坏氢键和分子间作用力,故冰的熔点远低于金刚石熔点。答案为:8;熔化时克服的分子间作用力不同,冰是氢键和分子间作用力,金刚石是共价键;
②由于NH3分子是三角锥形,N原子易提供孤电子对,所以,必以空间阻力最小,结构最稳定的方式形成氢键,则水合物NH3·H2O的结构式可表示为: 或
或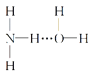 ;答案为:
;答案为: 或
或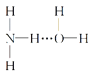 ;
;
(6)分析图甲中的a图,每白色小球被3个黑球共用,每一个黑球被6个白球共用,则黑色小球和白色小球个数之比为![]() ;b图中每个白色小球被2个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比=
;b图中每个白色小球被2个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比=![]() ,故表示CuCl2的晶体结构的是a图;金属晶体中金属原子的配位数即为距离该原子最近的金属原子的数目,在Cu的晶胞中,顶点原子为8个晶胞共用。面上的铜原子为2个晶胞共用,因此,金属铜的一个晶胞的原子数为
,故表示CuCl2的晶体结构的是a图;金属晶体中金属原子的配位数即为距离该原子最近的金属原子的数目,在Cu的晶胞中,顶点原子为8个晶胞共用。面上的铜原子为2个晶胞共用,因此,金属铜的一个晶胞的原子数为![]() ,在Cu的晶胞中,与每个顶点的Cu原子距离相等的铜原子共有12个,因此其配位数为12;由题可知,晶胞体积应为a3pm3,一个晶胞中含4个Cu原子,则一个晶胞的质量=
,在Cu的晶胞中,与每个顶点的Cu原子距离相等的铜原子共有12个,因此其配位数为12;由题可知,晶胞体积应为a3pm3,一个晶胞中含4个Cu原子,则一个晶胞的质量=![]() ,根据m=ρV,则有:
,根据m=ρV,则有:![]() ,故NA=
,故NA=![]() ;答案为:a;12;
;答案为:a;12;![]() 。
。

【题目】氨的合成原理为:N2(g)+3H2(g)2NH3(g)H=-92.4kJ·mol-1在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。回答下列问题:
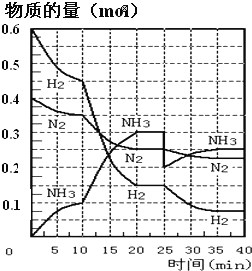
(1)10min内以NH3表示的平均反应速率为_________
(2)在10~20min内,NH3浓度变化的原因可能是_____________
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡:平衡常数K1=__________(带数据的表达式),第2次平衡时NH3的体积分数为_____________。
(4)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fc2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)2NH3+1.5O2(g)H=akJ·mol-1,进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a______0,△S_______0;(填“>”、“<”或一”)
②已知N2(g)+3H2(g)2NH3(g)H=-92.4kJ·mol-1,2 H2(g)+ O2(g)=2H2O(l)H=-571.kJ·mol-1 则常温下氮气与水反应生成氨气与氧气的热化学方程式为_____________________________