题目内容
8.下列事实,不能说明氯元素的非金属性比硫元素强的是( )| A. | 盐酸是强酸,氢硫酸是弱酸 | B. | HClO4酸性比H2SO4强 | ||
| C. | 氯气与H2S能发生置换反应 | D. | 受热时,氯化氢比硫化氢稳定 |
分析 元素的非金属性越强,其最高价氧化物的水化物酸性越强、其氢化物的稳定性越强、其单质的氧化性越强、其单质与氢气化合越容易,据此分析解答.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据氢化物的水溶液酸性强弱判断非极性强弱,故A选;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,高氯酸和硫酸分别是Cl、S元素的最高价氧化物的水化物,HClO4酸性比H2SO4强,说明Cl元素非极性比硫元素强,故B不选;
C.氯气与H2S能发生置换反应,氯气作氧化剂、S作氧化产物,氯气的氧化性大于S,说明Cl元素非极性比硫元素强,故C不选;
D.元素的非金属性越强,其氢化物越稳定,受热时,氯化氢比硫化氢稳定,说明Cl元素非金属性比S元素强,故D不选;
故选A.
点评 本题考查非金属性强弱判断,侧重考查学生知识运用能力,明确非金属性强弱判断方法是解本题关键,易错选项是A.

练习册系列答案
相关题目
18.以下反应属于吸热反应的是( )
| A. | 生石灰加水制熟石灰 | B. | 化石燃料的燃烧 | ||
| C. | 氢氧化钠溶液中滴加稀盐酸 | D. | 二氧化碳与高温的炭 |
19.已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族.A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子.下列说法正确的是( )
| A. | D元素最高价氧化物对应的水化物化学式H2YO4 | |
| B. | 原子半径由大到小的顺序为:B>D>E | |
| C. | B、C两种元素的气态氢化物中,C的气态氢化物较稳定 | |
| D. | A与B形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
16. 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 原子半径:己>辛>戊 | |
| B. | 辛是金属元素,元素符号为Ge | |
| C. | 丙与庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物. |
3.能通过化学反应使溴水褪色,又能使高锰酸钾溶液褪色的是( )
| A. | 苯 | B. | 乙醇 | C. | 乙烷 | D. | 乙烯 |
13.可逆反应2NO2$\frac{\underline{\;\;△\;\;}}{\;}$2NO+O2二氧化氮红棕色在密闭容器中反应,达到平衡状态的标志是( )
| A. | NO2、NO和O2三者共存 | |
| B. | 单位时间内生成n molO2的同时生成2n mol NO | |
| C. | 容器中颜色不再变化 | |
| D. | 容器中NO2、NO、O2的物质的量浓度之比为2:2:1的状态 |
20.对于CH3-CH=CH-C≡C-CF3分子结构的描述,下列叙述中,正确的是( )
| A. | 6个碳原子有可能都在一条直线上 | |
| B. | 分子中最多有12个原子在同一平面上 | |
| C. | 6个碳原子有可能都在同一平面上 | |
| D. | 6个碳原子不可能都在同一平面上 |
18.四个电解装置都以Pt做电极,它们分别装着如下电解质溶液进行电解,电解一段时间后,测定其pH变化,所记录的结果正确的是( )
| A | B | C | D | |
| 电解质溶液 | HCl | AgNO3 | BaCl2 | KOH |
| pH值变化 | 减小 | 增大 | 变大 | 不变 |
| A. | A | B. | B | C. | C | D. | D |
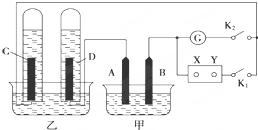 在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.
在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.