��Ŀ����
��1����ͼ��ʾ��A���ɵ��Ȳ����Ƴɵ��ܱ�������B��һ�ͻ�ѧ��ʴ�����ڴ��ȵ������ҡ��ر�K2������1 mol NO2ͨ��K1��K3�ֱ����A��B�У���Ӧ��ʼʱA��B�������ͬ��Ϊa L��

��B�п�ͨ��________________�жϿ��淴Ӧ2NO2 N2O4�Ѿ��ﵽƽ�⡣
N2O4�Ѿ��ﵽƽ�⡣
����ƽ�����A�������ٳ���0.5mol N2O4�������µ���ƽ���ƽ��������NO2���������_______________���� �������С�����䡱����
��������A�е���ƽ������ʱ��t s���ﵽƽ���������ѹǿΪ��ʼѹǿ��0.8������ƽ����ѧ��Ӧ����v(NO2)����____________________��
������K2��ƽ���B�������������0.4a L�����K2֮ǰ������B���Ϊ______L��
��2���õ��ķ�����������Һ����Ϊ��������о�������Ҫ��ʵ�����壬������ת��Ϊ�������ǵ�ⷨ�������������һ����Ҫ���ݡ�

��ͼ���ǵ������������ʵ��װ�ã�
����֪�����ķ�ӦΪ��(x+1)S2��=SxS2��+2xe����
�������ĵ缫��Ӧʽ�ǣ� ��
����Ӧת��xmol����ʱ���������������Ϊ ����״���£���
�ڽ�Na2S��9H2O����ˮ������������Һʱ��ͨ������
�����������ܽ⡣��ԭ���ǣ������ӷ�Ӧ����ʽ��ʾ���� ��

��B�п�ͨ��________________�жϿ��淴Ӧ2NO2
 N2O4�Ѿ��ﵽƽ�⡣
N2O4�Ѿ��ﵽƽ�⡣����ƽ�����A�������ٳ���0.5mol N2O4�������µ���ƽ���ƽ��������NO2���������_______________���� �������С�����䡱����
��������A�е���ƽ������ʱ��t s���ﵽƽ���������ѹǿΪ��ʼѹǿ��0.8������ƽ����ѧ��Ӧ����v(NO2)����____________________��
������K2��ƽ���B�������������0.4a L�����K2֮ǰ������B���Ϊ______L��
��2���õ��ķ�����������Һ����Ϊ��������о�������Ҫ��ʵ�����壬������ת��Ϊ�������ǵ�ⷨ�������������һ����Ҫ���ݡ�

��ͼ���ǵ������������ʵ��װ�ã�
����֪�����ķ�ӦΪ��(x+1)S2��=SxS2��+2xe����
�������ĵ缫��Ӧʽ�ǣ� ��
����Ӧת��xmol����ʱ���������������Ϊ ����״���£���
�ڽ�Na2S��9H2O����ˮ������������Һʱ��ͨ������
�����������ܽ⡣��ԭ���ǣ������ӷ�Ӧ����ʽ��ʾ���� ��
��14�֣�ÿ��2�֣�
��1���������Ҳ��ٱ�С����ɫ���ٱ仯
�ڱ�С
��0.4/at(mol.L-1.s-1)
��0.7a
��2����2H+ + 2e��=H2���� 11.2x L
��2S2����O2��2H2O=2S����4OH��
��1���������Ҳ��ٱ�С����ɫ���ٱ仯
�ڱ�С
��0.4/at(mol.L-1.s-1)
��0.7a
��2����2H+ + 2e��=H2���� 11.2x L
��2S2����O2��2H2O=2S����4OH��
�����������1�������Ҳ��ٱ�С����ɫ���ٱ仯ʱ����ʾ�����ʵ�Ũ�Ȳ��䣬����Ӧ�Ѵﵽƽ�⡣
����ƽ�����A�������ٳ���0.5mol N2O4��������ѹǿ��������ѹǿƽ�����������ʵ�����С�ķ����ƶ�������ƽ��������NO2�����������С��
����������ʽ���м��㣺��ת����NO2�����ʵ���Ϊx��2NO2
 N2O4
N2O4��ʼ���ʵ�����mol�� 1 0
ת�����ʵ�����mol�� x x/2
ƽ�����ʵ�����mol�� 1-x x/2
�ﵽƽ���������ѹǿΪ��ʼѹǿ��0.8������1-x+x/2����1="0.8" ��x=0..4mol����V(NO2)=0.4mol��aL��ts=0.4/at(mol.L-1.s-1)��
�ܴ�K2�����൱�����ڵ��µ�ѹʱ��ƽ�⣬���ƽ���ǵ�Ч�ģ����ڴ�ʱ��Ӧ������ʵ�����B�еĶ��������Դ�K2֮ǰ������B���Ϊ��aL+0.4aL����2=0.7aL��
��2����NaOH��Һ��H2O�������H+�������Ϸŵ磺2H+ + 2e��=H2�������ݻ��ϼ۵ı仯��֪��H2����ӵĶ�Ӧ��ϵΪ��H2 �� 2e?��V(H2)=xmol��1/2��22.4L/mol=11.2x L��
���ڵ����������ܽ�ɷ�ֹS2?��O2����������ֹ2S2����O2��2H2O=2S����4OH�� ������

��ϰ��ϵ�д�
 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�
�����Ŀ
 4NO��g����6H2O��g��������˵����ȷ���ǣ� ��
4NO��g����6H2O��g��������˵����ȷ���ǣ� �� 2C��g��+xD��g��DH��0 ��5min��ƽ�⣬��ʱ����2molC�����D��ƽ����Ӧ����Ϊ0.1mol��(L��min)-1.����˵������ȷ����
2C��g��+xD��g��DH��0 ��5min��ƽ�⣬��ʱ����2molC�����D��ƽ����Ӧ����Ϊ0.1mol��(L��min)-1.����˵������ȷ���� 2C����������H<0 ���� 2 s���룩���� C ��Ũ��Ϊ0.6 mol��L��1 ���������м���˵����
2C����������H<0 ���� 2 s���룩���� C ��Ũ��Ϊ0.6 mol��L��1 ���������м���˵���� 2C(g)(����Ӧ����)������ͼ����ȷ����
2C(g)(����Ӧ����)������ͼ����ȷ����
 CO(g)+3H2 (g)����I CO(g)+2H2(g)
CO(g)+3H2 (g)����I CO(g)+2H2(g) 



 ��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
 ����Ӧ��
����Ӧ��
 ��
�� ��
�� ���ﵽƽ��ǰv������>v���棩
���ﵽƽ��ǰv������>v���棩 ��
�� ���ﵽƽ��ʱ��
���ﵽƽ��ʱ�� ��ת����С��80%
��ת����С��80% 2C(g)���ﵽƽ��������¶�ʱ��A��ת���ʱ�С������Сѹǿʱ�������ϵ��C�������������䣬��:
2C(g)���ﵽƽ��������¶�ʱ��A��ת���ʱ�С������Сѹǿʱ�������ϵ��C�������������䣬��: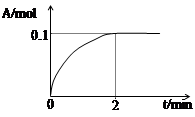
 2NH3(g)��20 min��N2�����ʵ���Ϊ1.9 mol��1 h���������������ѹǿ���ٸı䣬��Ϊ��Ӧ��ʼʱѹǿ��0.8����������������ȷ���ǣ� ��
2NH3(g)��20 min��N2�����ʵ���Ϊ1.9 mol��1 h���������������ѹǿ���ٸı䣬��Ϊ��Ӧ��ʼʱѹǿ��0.8����������������ȷ���ǣ� ��