题目内容
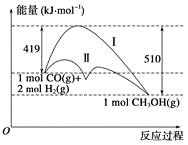
【题目】KClO3热分解是实验室制取氧气的一种方法,1molKClO3(s)热分解的能量变化如图所示。实验测得第一放热温度为400℃,第二放热温度为480℃。下列说法正确的是( )
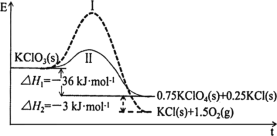
A.400℃时KClO3热分解的产物是KCl和O2
B.若用MnO2作催化剂,KClO3热分解温度大于480℃
C.曲线Ⅰ的活化能大于曲线Ⅱ,所以KClO3比KClO4稳定
D.2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78kJ·mol1
【答案】D
【解析】
根据图示,反应Ⅰ的活化能大于反应Ⅱ,所以反应Ⅰ为480℃时的反应,反应Ⅱ为400℃时的反应。
A. 反应Ⅰ为480℃时的反应,480℃时KClO3热分解的产物是KCl和O2,故A错误;
B. 催化剂降低反应的活化能,若用MnO2作催化剂,KClO3热分解温度小于480℃,故B错误;
C. 能量越低越稳定,KClO3的能量大于KClO4,所以KClO4比KClO3稳定,故C错误;
D.根据图示,1mol KClO3(s)生成1molKCl(s)和1.5molO2(g)放热36+3=39kJ,所以2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78kJ·mol1,故D正确。

练习册系列答案
相关题目