题目内容
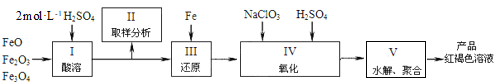
【题目】工业上常以闪锌矿(主要成分ZnS,含Fe、Cu、Cd等元素的杂质)为原料,通过火法或湿法炼锌,两种方法都是先将闪锌矿焙烧得到以ZnO为主要成分的焙砂,再分别制得锌。具体流程如下:
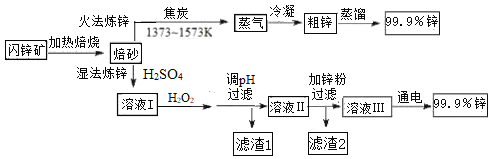
已知:
Fe3+ | Zn2+ | Cu2+ | Fe2+ | Cd2+ | |
开始沉淀的pH | 1.1 | 5.9 | 4.7 | 7.6 | 6.9 |
沉淀完全的pH | 3.2 | 8.1 | 6.7 | 9.6 | 9.7 |
(1)火法炼锌涉及的主要反应:
2C(s) + O2(g) = 2CO(g) H=﹣220 kJ· mol-1
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) H=﹣930 kJ· mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) H= +198 kJ· mol-1
则ZnS(s) + 2O2(g) + C(s) = Zn(g) +CO2(g) + SO2(g) 的H=_______________。
(2)湿法炼锌工艺中加入双氧水的目的是____________,调节pH的范围是________,滤渣1的成分是___________(写化学式),滤渣2的成分是___________(写化学式)。
(3)含锌废液是造成环境污染的重要原因之一。
①已知氢氧化锌和氢氧化铝性质相似。向电解后废液中加入稍过量的KOH溶液(假设其他物质不与碱反应),发生反应的离子方程式是_______________。
②一种生产锌的新技术碱浸—电解法的原理是:将ZnO溶于KOH溶液得到四羟基合锌酸钾[K2Zn(OH)4]溶液,再电解该溶液即获得金属锌。用石墨电极电解时阴极的反应式是___________。
【答案】﹣377 kJ· mol-1 氧化Fe2+生成Fe3+,便于形成沉淀除去 3.2 ≤ pH <5.9(或3.2 ≤ pH <4.7) Fe(OH)3、Cu(OH)2(对应后一个答案填Fe(OH)3) Cu、Zn、Cd Zn2++2OH-═Zn(OH)2↓、Zn(OH)2+2OH- ═[Zn(OH)4]2-或Zn2+ + 4OH- = [Zn(OH)4]2- [Zn(OH)4]2- + 2e- = Zn + 4OH-
【解析】
流程的目的是分别用湿法和火法,以闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)为原料冶炼锌单质,两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。分析火法流程,ZnO和焦炭在1373K~1573K时反应,发生氧化还原反应,主要制得Zn(g)、Cd(g)和残渣,残渣则主要是Fe和Cu,将Zn(g)和Cd(g)冷凝得到粗锌和粗镉,经蒸馏得到99.9%的锌;
湿法流程,将ZnO用硫酸溶解制得溶液I,此时溶液中还含有Cu2+,Fe2+,Cd2+等,加入H2O2溶液氧化Fe2+为Fe3+,调节溶液pH,过滤可以将溶液和不溶于硫酸的残渣分离,可除去Fe3+,用Zn置换出溶液Ⅱ中的杂质元素Cd2+和Cu2+,同时可增加溶液中Zn的产量,通过过滤操作分离出的滤渣主要为Cd和Cu,溶液中主要含有Zn2+,再电解溶液制得99.99%的锌,以此解答该题。
(1)①2C(s)+O2(g)═2CO(g)△H1=-220kJmol-1
②2ZnS(s)+3O2(g)═2ZnO(s)+2SO2(g)△H2=-930kJmol-1
③ZnO(s)+CO(g)═Zn(g)+CO2(g)△H3=198kJmol-1
将方程式
(①+②+ 2③)/2 得ZnS(s)+C(s)+2O2(g)═Zn(g)+CO2(g)+2SO2(g),△H4=(-220-930+2x198)/2=-377.0kJ/mol ;
(2)加入H2O2溶液氧化Fe2+为Fe3+,调节溶液pH,过滤可以将溶液和不溶于硫酸的残渣分离,可除去Fe3+,生成Fe(OH)3,由表中数据可知pH应3.2 ≤ pH <5.9(或3.2 ≤ pH <4.7),如果3.2 ≤ pH <5.9这时一部分Cu(OH)2也会析出,对应的滤渣1的成分是 Fe(OH)3、Cu(OH)2如果pH3.2 ≤ pH <4.7,对应的滤渣1的成分是 Fe(OH)3用Zn置换出溶液Ⅱ中的杂质元素Cd2+和Cu2+,得到滤渣2为Zn、Cd、Cu;
(3)①已知氢氧化锌和氢氧化铝性质相似。向电解后废液中加入过量的KOH溶液,反应的离子方程式为Zn2++2OH-═Zn(OH)2↓、Zn(OH)2+2OH- ═[Zn(OH)4]2-或Zn2+ + 4OH- = [Zn(OH)4]2-;
②阴极发生还原反应,电极反应式为[Zn(OH)4]2-+2e-=Zn+4OH-。