题目内容
18.原电池与电解池在化学工业中有广泛应用.如右图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题:
(1)若断开K1,闭合K2,则:
①该装置为原电池;
②X电极上的电极反应式为Fe-2e-=Fe2+;
③电解液中的阳离子向Y极移动(填X或Y)
(2)若若断开K2,闭合K1,则
①该装置的总反应为CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑;
②若线路中通过3.01ⅹ1022的电子,则X极上析出物的质量为1.6g;
③检验Y电极反应产物的方法是用湿润的淀粉碘化钾试纸置于支管口处,试纸变蓝说明有氯气生成.
分析 (1)若断开K1,闭合K2,则形成了原电池,铁(X)为负极,碳棒(Y)为正极,负极铁失去电子生成亚铁离子:Fe-2e-=Fe2+;电流从正极流向负极,外电路中,溶液中恰好相反,正电荷移动方向与电流方向一致,据此进行解答;
(2)若断开K2,闭合K1,则构成了电解质,电解硫酸铜溶液:CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑,Y(碳棒)为阳极,X(铁)为阴极,阳极氯离子失去电子生成氯气,阴极铜离子得到电子生成铜单质,根据电子守恒计算出生成铜的质量;Y极生成的是氯气,根据检验氯气的常用方法解答.
解答 解:(1)①若断开K1,闭合K2,则形成了原电池,铁为负极,碳棒为正极,
故答案为:原电池;
②负极铁失去电子生成亚铁离子,电极反应式为:Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
③X为负极、Y为正极,外电路中电流从Y流向X,溶液中电流从X流向Y,则正电荷流向Y,
故答案为:Y;
(2)①若断开K2,闭合K1,则构成了电解质,电解硫酸铜溶液:CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑,Y(碳棒)为阳极,X(铁)为阴极,阳极氯离子失去电子生成氯气,阴极铜离子得到电子生成铜单质,
故答案为:CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑;
②若线路中通过3.01ⅹ1022的电子,电子的物质的量为:$\frac{3.01×1{0}^{22}}{6.02×1{0}^{23}mol}$=0.05mol,X极上析出铜,根据电子守恒,则X极上析出铜的质量为:64g/mol×$\frac{0.05mol}{2}$=1.6g,
故答案为:1.6g;
③Y为阳极,氯离子失去电子生成氯气,检验氯气的方法为:用湿润的淀粉碘化钾试纸置于支管口处,试纸变蓝说明有氯气生成,
故答案为:用湿润的淀粉碘化钾试纸置于支管口处,试纸变蓝说明有氯气生成.
点评 本题考查了原电池原理、电解原理及其应用,题目难度中等,注意掌握原电池、电解池工作原理,明确常见气体的检验方法及电子守恒在化学计算中的应用方法.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案| A. | 甲醇、乙醇、乙醛、乙酸(银氨溶液) | |
| B. | 苯、苯酚水溶液、1-已烯、四氯化碳(溴水) | |
| C. | 乙烯、四氯化碳、苯(KMnO4酸性溶液) | |
| D. | 乙酸、甲酸甲酯、乙酸乙酯新制[Cu(OH)2悬浊液] |
| A. | 加热能杀死流感病毒是因为病毒的蛋白质受热发生变性 | |
| B. | 在豆浆中加少量石膏,能使豆浆凝结为豆腐 | |
| C. | 蛋白质水解的最终产物是氨基酸 | |
| D. | 任何结构的蛋白质遇到浓硝酸都会变成黄色 |
| A. | Cl?的结构示意图: | B. | 氯化氢的电子式为: | ||
| C. | 甲烷的比例模型: | D. | 乙醛的结构简式:C2H4O |
| A. | C2H5OH | B. | CH2C12 | C. | C3H8 | D. |  |
| A. | 乙烯的结构简式为CH2=CH2 | B. | CH4分子的比例模型: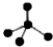 | ||
| C. | 8个中子的碳原子的符号:12C | D. | 氯化镁的电子式: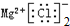 |
| A. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 用Pt电极电解饱和氯化镁溶液:2Cl-+2H2$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
 ,关于M的说法正确的是( )
,关于M的说法正确的是( )| A. | M中只有两种官能团 | |
| B. | 1 molM最多能消耗2 mol NaOH | |
| C. | M能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色 | |
| D. | M可以发生酯化、加成反应,不能发生聚合反应 |