题目内容
14. 下表为某市售盐酸试剂瓶标签上的部分信息:
下表为某市售盐酸试剂瓶标签上的部分信息:(1)该盐酸的物质的量浓度为11.8mol/L;
(2)取该盐酸50mL加水稀释到500mL,则稀释后溶液中c(HCl)=1.18mol/L;
(3)取稀释后的该500mL盐酸与足量的锌粒作用,生成标准状况下气体的体积是6.608L.
分析 (1)根据物质的量浓度c=$\frac{1000ρω}{M}$计算出该盐酸的物质的量浓度;
(2)稀释过程中溶质的物质的量不变,据此计算出稀释后溶液中盐酸的浓度;
(3)根据H元素质量守恒计算出生成氢气的物质的量,再根据V=nVm计算出生成氢气的体积.
解答 解:(1)该盐酸的物质的量浓度为:c=$\frac{1000ρω}{M}$=$\frac{1000×1.18×36.5%}{36.5}$mol/L=11.8mol/L,
故答案为:11.8mol/L;
(2)取该盐酸50mL加水稀释到500mL,稀释过程中氯化氢的物质的量不变,则稀释后溶液中c(HCl)=$\frac{11.8mol/L×0.05L}{0.5L}$=1.18mol/L,
故答案为:1.18mol/L;
(3)500mL稀释后的溶液中含有HCl的物质的量为:1.18mol/L×0.5L=0.59mol,根据氢元素守恒可知生成氢气的物质的量为:$\frac{1}{2}$×0.059mol=0.295mol,
则生成的氢气在标况下的体积为:22.4L/mol×0.295mol=6.608L,
故答案为:6.608L.
点评 本题考查了物质的量浓度的计算、化学反应的计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,明确质量守恒定律在化学计算中的应用方法.

练习册系列答案
相关题目
4.配制一定浓度的硫酸溶液时,下列操作会使所配溶液浓度偏小的是( )
| A. | 用量筒量取所需浓硫酸时,仰视刻度线 | |
| B. | 将量筒中的浓硫酸倒入烧杯后,没有用水冲洗量筒2-3次并转移至烧杯中 | |
| C. | 用胶头滴管滴加蒸馏水定容时,仰视刻度线 | |
| D. | 定容摇匀后,液面下降,没有重新加蒸馏水至刻度线 |
5.碳原子数为12且只有两个侧链的苯的同系物的同分异构体数目为( )
| A. | 42 | B. | 45 | C. | 48 | D. | 60 |
6.取100mL0.3mol•L-1的H2SO4溶液和300mL0.25mol•L-1的H2SO4溶液配成500mL的溶液所得溶液中H+的物质的量浓度为( )
| A. | 0.265mol•L-1 | B. | 0.525mol•L-1 | C. | 0.21mol•L-1 | D. | 0.42mol•L-1 |
14.在溶液中能大量共存的离子组是 ( )
| A. | Al3+、Cl-、Ca2+ | B. | Mg2+、SO42-、OH- | C. | Na+、SO32-、H+ | D. | H+、K+、OH- |
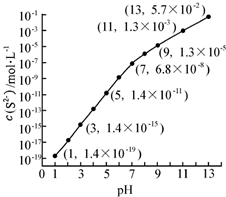 (1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
(1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).