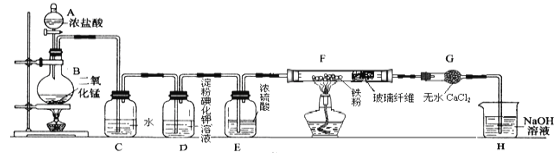
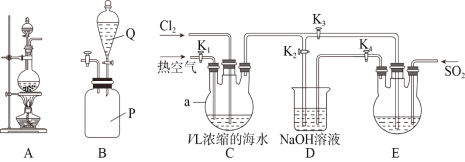
��Ŀ����
����Ŀ������п�̵�����ճ����������������ĵ�أ��乹����ͼ��ʾ���ŵ�ʱ�ܷ�ӦΪ��Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH��
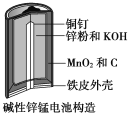
�ӷϾɼ���п�̵���л���Zn��MnO2�Ĺ�����ͼ��ʾ��
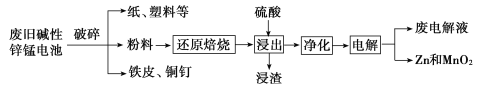
�ش��������⣺
(1)MnOOH�У�MnԪ�صĻ��ϼ�Ϊ_________��
(2)����ԭ�����������У��۽��������ﱻ��ԭΪ�ͼ���������������(����MnOOH��MnO2����ԭ��MnO)����Ҫԭ�������������к���_________��
(3)����������Ϊ�˳�ȥ����Һ�е�Fe2���������ǣ�����______(�ѧʽ)��Һ��Fe2������ΪFe3�����ٵ���pHʹFe3��������ȫ�������£���֪����Һ��Mn2����Zn2����Ũ��ԼΪ0.1 mol/L�������������ݼ��㣬����pH�ĺ�����Χ��______��__________��(����Ũ��С��1��10��5 mol/L��Ϊ������ȫ)
������ | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp����ֵ | 10��13 | 10��17 | 10��38 |
(4)�������ʱ�������ĵ缫��ӦʽΪ_________����������Ӧѭ�����õ�������_______(�ѧʽ)��
(5)������������ֱ�������Ṳ�ȷ�Ӧ����ˣ���Һ����Ҫ�ɷ���ZnCl2��MnCl2��������һ�ֻ���ɫ���壬���������е�MnOOH�����ᷴӦ�Ļ�ѧ����ʽΪ__________��
���𰸡���3 C H2O2(��KMnO4) 3 6 Mn2��-2e��+2H2O=MnO2��4H�� H2SO4 2MnOOH+6HCl![]() Cl2��+2MnCl2+4H2O
Cl2��+2MnCl2+4H2O
��������
(1)���ݻ��ϼ۴�����Ϊ0���㣻
(2-4)�Ͼɼ���п�̵�ط����к���̼���л�ԭ�ԣ�����ԭ�����������У�̼���۽��������ﱻ��ԭΪ�ͼ���������������(����MnOOH��MnO2����ԭ��MnO)�����������ܽ�����п��MnO�õ�MnSO4��Һ������Fe2+��Zn2+�����������м���H2O2��Һ������Fe2+����ΪFe3+���ٵ���pHʹFe3+��ȫ���������յõ�MnSO4��Һ��Zn2+���������Mn2+ʧ���ӷ���������Ӧ����MnO2������Zn2+�õ��ӷ�����ԭ��Ӧ����Zn���ϵ��ҺΪ���ᣬ�ݴ˷������
(5)����MnOOH���������ԣ������ᷢ��������ԭ��Ӧ��д��ѧ����ʽ��
(1)���ݻ��ϼ۴�����Ϊ0����MnOOH�У�OΪ-2�ۣ�HΪ+1�ۣ�����MnԪ�صĻ��ϼ�Ϊ+3�ۣ�
(2)�Ͼɼ���п�̵�ط����к���̼���л�ԭ�ԣ�����ԭ�����������У�����̼���۽��������ﱻ��ԭΪ�ͼ��������������ʣ�����MnOOH��MnO2����ԭ��MnO����
(3)����������Ϊ�˳�ȥ����Һ�е�Fe2+������H2O2��Һ���������Խ�Fe2+����ΪFe3+������Mn(OH)2��Zn(OH)2��Ksp����ֵ�����Mn2+��Zn2+��ʼ����ʱ��������Ũ�ȷֱ�Ϊ
![]() =10-6��
=10-6��![]() =10-8����Mn2+��Zn2+��ʼ����ʱ��pH�ֱ�Ϊ8��6����Fe(OH)3������ȫʱ��������Ũ��Ϊ
=10-8����Mn2+��Zn2+��ʼ����ʱ��pH�ֱ�Ϊ8��6����Fe(OH)3������ȫʱ��������Ũ��Ϊ![]() =10-11��Fe(OH)3������ȫʱ��pHΪ3�����Ե���pH�ĺ�����Χ�� 3��6��ʹFe3+��ȫ������Mn2+��Zn2+��������
=10-11��Fe(OH)3������ȫʱ��pHΪ3�����Ե���pH�ĺ�����Χ�� 3��6��ʹFe3+��ȫ������Mn2+��Zn2+��������
(4)���ʱ��������Mn2+ʧ���ӷ���������Ӧ������Һ�е�ˮ������Ӧ����MnO2��ˮ���������ĵ缫��ӦʽΪMn2+-2e-+2H2O=MnO2+4H+������������Һ�е�Zn2+�õ��ӷ�����ԭ��Ӧ���ɵ���Zn���ϵ��ҺΪ���ᣬ��˱�������Ӧѭ�����õ�������H2SO4��
(5)���������е�MnOOH���������ԣ������ᷢ��������ԭ��Ӧ������MnCl2��Cl2��H2O�����ݵ����غ㡢ԭ���غ㣬�ɵø÷�Ӧ�Ļ�ѧ����ʽΪ2MnOOH+6HCl![]() 2MnCl2+Cl2��+4H2O��
2MnCl2+Cl2��+4H2O��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�