题目内容
(1)0.1mol/L Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式 ;
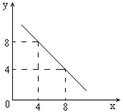
(3)某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示,该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。
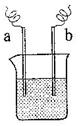
(4)如图装置,已知两电极上发生的电极反应分别为:
a极:Cu2++2e-= Cu b极:Fe-2e-= Fe2+
该装置中原电解质溶液一定含有 ;(填序号)
(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s) Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1。
Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1。
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式 ;
(3)某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示,该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。

(4)如图装置,已知两电极上发生的电极反应分别为:
a极:Cu2++2e-= Cu b极:Fe-2e-= Fe2+
该装置中原电解质溶液一定含有 ;(填序号)
| A.Cu2+ | B.Na+ | C.Fe2+ | D.Ag+ |

(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s)
 Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1。
Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1。(1)碱性 CO32-+H2O HCO3-+OH- (2)负极:2H2+4OH- -4e="4" H2O
HCO3-+OH- (2)负极:2H2+4OH- -4e="4" H2O
(3)1×1012 10 (4)A (5)1.1×10-9
 HCO3-+OH- (2)负极:2H2+4OH- -4e="4" H2O
HCO3-+OH- (2)负极:2H2+4OH- -4e="4" H2O(3)1×1012 10 (4)A (5)1.1×10-9
(1)碳酸钠属于强碱弱酸盐,水解显碱性,反应式为CO32-+H2O HCO3-+OH-。
HCO3-+OH-。
(2)原电池负极失去电子,所以氢气在负极通入,反应式为2H2+4OH- -4e="4" H2O。
(3)由图像可知,当x=4时,y=8,所以该温度下水的离子积为1×1012。0.01 mol/L NaOH溶液的中OH-的浓度为0.01mol/L,所以氢离子的浓度为10-10mol/L,则pH值等于10。
(4)a电极是得到电子的,发生还原反应。所以溶液中一定含有铜离子,答案选A。
(5)0.1 mol·L一1硫酸溶液中,SO42-的浓度为0.1mol/L,所以钡离子的浓度最大为1.1×10-9 mol·L一1。
 HCO3-+OH-。
HCO3-+OH-。(2)原电池负极失去电子,所以氢气在负极通入,反应式为2H2+4OH- -4e="4" H2O。
(3)由图像可知,当x=4时,y=8,所以该温度下水的离子积为1×1012。0.01 mol/L NaOH溶液的中OH-的浓度为0.01mol/L,所以氢离子的浓度为10-10mol/L,则pH值等于10。
(4)a电极是得到电子的,发生还原反应。所以溶液中一定含有铜离子,答案选A。
(5)0.1 mol·L一1硫酸溶液中,SO42-的浓度为0.1mol/L,所以钡离子的浓度最大为1.1×10-9 mol·L一1。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
 2NH4+ + SO42-
2NH4+ + SO42- 2H+ + CO32-
2H+ + CO32-