题目内容
下列关于pH的说法正确的( )
| A、强酸溶液的pH值一定比弱酸溶液小 | B、pH值等于7的溶液,一定是中性的溶液 | C、常温下,由水电离出的c(H+)=10-12mol/L,则溶液pH一定为12 | D、常温下,pH=10的氨水溶液中,OH-总浓度与由水电离出的OH-浓度之比为106 |
分析:A.PH=-lg[H+],与酸的强弱无关;
B.溶液的酸碱性取决于氢离子浓度与氢氧根离子浓度的大小;
C.常温下,由水电离出的c(H+)=10-12mol/L,说明水的电离受到抑制,该溶液可能是酸也可能是碱;
D.依据Kw=[H+][OH-],计算出OH-浓度,据此解答.
B.溶液的酸碱性取决于氢离子浓度与氢氧根离子浓度的大小;
C.常温下,由水电离出的c(H+)=10-12mol/L,说明水的电离受到抑制,该溶液可能是酸也可能是碱;
D.依据Kw=[H+][OH-],计算出OH-浓度,据此解答.
解答:解:A.溶液的pH值大小取决于氢离子浓度大小,与酸的强弱无关,故A错误;
B.水的离子积常数与温度有关,pH值等于7的溶液,氢离子浓度不一定等于氢氧根离子浓度,故B错误;
C.常温下,由水电离出的c(H+)=10-12mol/L,说明水的电离受到抑制,则溶液pH可能为12或者2,故C错误;
D.常温下,pH=10的氨水溶液中,水电离出的氢氧根离子浓度等于水电离出的氢离子浓度=10-10mol/L;OH-总浓度=
=
=10-4(mol/L),OH-总浓度与由水电离出的OH-浓度之比=
=1O6,故D正确;
故选:D.
B.水的离子积常数与温度有关,pH值等于7的溶液,氢离子浓度不一定等于氢氧根离子浓度,故B错误;
C.常温下,由水电离出的c(H+)=10-12mol/L,说明水的电离受到抑制,则溶液pH可能为12或者2,故C错误;
D.常温下,pH=10的氨水溶液中,水电离出的氢氧根离子浓度等于水电离出的氢离子浓度=10-10mol/L;OH-总浓度=
| Kw |
| [H+] |
| 10-14 |
| 10-10 |
| 10-4 |
| 10-10 |
故选:D.
点评:本题考查了水的电离平衡的影响因素和溶液的酸碱性与pH值的关系,题目难度不大,易错选项为C,注意酸和碱都能够抑制水的电离.

练习册系列答案
相关题目


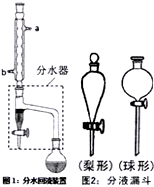 实验室制备乙酸正丁酯的化学方程式:
实验室制备乙酸正丁酯的化学方程式: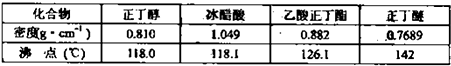

 CO2(g)+H2(g)”中的△H大于0
CO2(g)+H2(g)”中的△H大于0 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化